Cardiorete 2011
Menu principale:
- Home Page
- Gregorio
- Rosato
- Boccanelli
- Simonetti
- Bovenzi
- Tozzi
- Caldarola
- Gnarra
- Giudice
- Palermo
- Capomolla
- Progetto Cardio
- Longobardi
- Santoro M.
- Citro
- Capuano
- Riccio
- Mazzuoli
- Severino
- Santomauro
- Caso
- Miceli
- Gallo
- Sibilio
- Scardovi
- Ravera
- Aloia
- Murena
- Citera
- Elia
- Viceconti
- Ardissino
- Scardi
- Violini
- Perna
- Di Benedetto
- Baldi
- Panza
- Piazza
- Piscione
- Silvestri
- Di Gregorio
- Cillo
- Campana
- Mascia
- Ducceschi
- Tedesco
- Bellizzi
- Oltrona Visconti
- Merlini
- D'Angelo
- Gabrielli
- Santoro
- Gulizia
- Meucci
- Salerno
Piscione
PROCESSO ALL'IMPIANTO PERCUTANEO DI VALVOLA AORTICA: LA DIFESA
Tullio Niglio, Giuseppe Di Gioia, Chiara De Biase, Federico Piscione
Dipartimento di Medicina Clinica , Scienze Cardiovascolari ed immunologiche - Università Federico II NapoliI
La stenosi aortica è attualmente la più frequente patologia valvolare in Italia e negli altri paesi sviluppati, si manifesta prevalentemente come forma calcifica in soggetti di età avanzata (2-7% della popolazione > 65 anni), mentre nei soggetti più giovani presenta un'eziologia prevalentemente congenita. [1]
Si caratterizza per un decorso cronico e progressivo, che presenta una fase di latenza asintomatica alquanto variabile ma che può raggiungere anche alcuni decenni, con un esordio clinico che generalmente avviene durante la sesta-settima decade di vita, in seguito all'esaurimento dei meccanismi di compenso innescati dalla riduzione dell'area valvolare. Durante la fase di latenza clinica si verifica una progressiva calcificazione delle cuspidi valvolari che porta ad una riduzione dell'area valvolare, normalmente compresa tra 2,5 e 3,5 cm². Quando l'area valvolare si riduce del 50% si instaurano progressivamente una serie di meccanismi di compenso: la pressione sistolica e diastolica aumentano, così come il tempo di eiezione sistolica; mentre la pressione aortica diminuisce, venendosi ad instaurare un gradiente transvalvolare. [2]
Il sovraccarico pressorio sopra descritto porta il ventricolo ad ispessirsi, ma non a dilatarsi, determinando così un'ipertrofia concentrica nella quale la frazione di eiezione è conservata. L'ispessimento delle pareti ventricolari, unito all'aumento del tempo di eiezione e alla riduzione della pressione aortica determina anche un certo grado di ischemia miocardica, che peggiora la funzione del ventricolo sinistro.
Quando l'area valvolare diventa <1 cm², i meccanismi di compenso vanno incontro ad esaurimento per il crearsi di uno squilibrio tra la funzione di pompa del ventricolo sinistro e postcarico (afterload mismatch),il ventricolo si dilata, le pressioni di riempimento ventricolare e polmonare aumentano, mentre la frazione d'eiezione diminuisce drasticamente. [3]
Le raccomandazioni di Classe I delle Linee Guida ACC/AHA [1] prevedono l'intervento chirurgico sostitutivo della valvola aortica in presenza di:
" Pazienti sintomatici con stenosi aortica severa (area <1 cm²; gradiente medio >40 mmHg; velocità massima >4 m/sec, indice area valvolare < 0,6 cm²/m²).
" Pazienti con stenosi aortica severa sottoposti a CABG.
" Pazienti con stenosi aortica severa sottoposti a chirurgia aortica o altra chirurgia valvolare.
" Pazienti con stenosi aortica severa e disfunzione ventricolare sinistra (FE <50%).
Ad oggi, come si vede, il gold standard del trattamento della stenosi aortica è certamente l'intervento cardochirurgico con sostituzione valvolare, tuttavia in
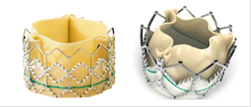
FIGURA 1: A sinistra Medtronic-CoreValve™;
a destra: due modelli di Edwards-SAPIEN™.
diverse casistiche è evidenziato come circa un terzo di coloro i quali abbiano una chiara indicazione al trattamento chirurgico in realtà non venga operato, in particolare a causa dell'elevato rischio anestesiologico e/o operatorio e delle comordità (soprattutto coronaropatia, ictus, insufficienza renale, diabete, arteriopatia periferica) che spesso sono presenti in una popolazione di pazienti nella stragrande maggioranza dei casi anziana. [4,6]
Questo dato si scontra chiaramente con l'evidenza che la comparsa dei sintomi (insorgenza di angina pectoris, sincope, episodio di scompenso cardiaco congestizio) è da considerare potenzialmente come un vero e proprio "punto di non ritorno" dal momento che la prognosi, in assenza di interventi adeguati, cala drasticamente con una aspettativa media di vita che varia da 1 a 3 anni. [2]
La terapia medica a base di nitrati o diuretici al fine di ridurre il precarico o con calcio-antagonisti per ridurre il postcarico non può essere una soluzione efficace nel prevenire o rallentare la progressione della valvulopatia così come diversi studi hanno evidenziato risultati discutibili a breve e medio termine per quanto riguarda la valvuloplastica aortica con pallone, ormai utilizzata soprattutto come tecnica "ponte" al fine di migliorare la funzionalità cardiaca consentendo quindi al paziente di rientrare nelle indicazioni chirurgiche. [7,8] Conseguentemente non sostituire la valvola, ove indicato, significa porre a serio e reale rischio la sopravvivenza dell'individuo.
Una risposta terapeutica per questo particolare subset di pazienti deriva dalla TAVI (Transcatheter Aortic Valve Implantation), che può avvalersi di un approccio retrogrado con accesso transfemorale o transucclavia, o anterogrado con accesso transapicale, e di due tipi di protesi valvolari attualmente presenti sul mercato (Medtronic-CoreValve™ ed Edwards-SAPIEN™). (vedi Figura 1)
Il PARTNER Trial [9], arruolando in uno studio randomizzato 358 pazienti con stenosi aortica considerati non idonei ad intervento chirurgico di sostituzione valvolare, ha dimostrato l'inequivocabile vantaggio della TAVI sulla terapia medica standard (compresa la valvuloplastica con pallone, eseguita in questo studio nell'83.8% dei casi) e come quest'ultima non modifichi la storia naturale della stenosi aortica severa. Di fatti, ad 1 anno, il tasso di morte globale (che a 30 giorni non mostrava differenza trai 2 gruppi) era del 30.7% nei pazienti sottoposti a TAVI rispetto al 50% di coloro che seguivano la terapia medica, il tasso dell'endpoint composto da morte per tutte le cause e nuova ospedalizzazione era il 42.5% rispetto al 71.6% del secondo gruppo; inoltre i pazienti TAVI sopravvissuti dopo 1 anno mostravano una incidenza di sintomatologia cardiaca con classe NYHA III-IV che era più che dimezzata rispetto all'altro gruppo di trattamento (25.2% vs 58%). Gli Autori descrivevano però una incidenza maggiore nel gruppo TAVI di eventi quali Stroke (5% vs 1.1%) e complicanze vascolari maggiori (16.2% vs 1.1%), quest'ultime spiegabili con un approccio esclusivamente trans femorale nei pazienti sottoposti a TAVI.
Dal primo impianto valvolare trans catetere, avvenuto nel 2002, le evidenze al riguardo di questa tecnica, che considerare ancora totalmente sperimentale appare fortemente riduttivo, si sono moltiplicate negli ultimi anni: il registro prospettico multicentrico FRANCE [10] ha arruolato 244 pazienti consecutivi; i criteri di inclusione sono stati stenosi severa, dispnea grave (NYHA>II) ed un elevato rischio chirurgico (Logistic-EuroScore >20%, STS score >10%). Sono state utilizzate entrambe le bioprotesi valvolari con approccio prevalentemente transfemorale con un successo procedurale raggiunto nel 97% dei casi. Dopo l'impianto sono stati registrati immediati cambiamenti di natura emodinamica quali un miglioramento post procedura del gradiente medio transvalvolare (46 vs 10 mmHg) e dell'area valvolare (0.68 vs 1.74 cm²), mostrando un rigurgito aortico post impianto prevalentemente (90.5%) di grado 0-1. La mortalità a 30 giorni, endpoint primario dello studio, si è verificata nel 12.7% dei casi, un dato assolutamente accettabile considerato le caratteristiche di alto rischio della popolazione selezionata, in assenza inoltre di una differenza statisticamente significativa tra l'utilizzo dei due tipi di valvola e tra i diversi accessi procedurali. Inoltre dall'analisi uni e multivariata di oltre 30 fattori di rischio è emerso come il pregresso by-pass aorto-coronarico e un Euroscore >20% siano gli unici predittori di mortalità a 30 giorni. I risultati a 6 mesi dello studio, tuttora in corso (che pone come endpoint secondario una valutazione a 3 anni di mortalità, MACE -Eventi Cardiovascolari Maggiori- e dati emodinamici), sembrano attestarsi su percentuali simili a quelle riportate da altri studi.
Uno studio ancora più ampio deriva da un registro multicentrico italiano [11] in cui sono stati arruolati 772 pazienti con elevato profilo di rischio (Logistic-EuroScore medio 23%, 70.6% con classe NYHA III-IV, 48.2% con CAD) cui è stata impiantata una bioprotesi valvolare CoreValve prevalentemente per via transfemorale (88.6%). Il successo procedurale è stato del 98% e la sopravvivenza globale ad un anno dell'85% conferma la sicurezza di tale approccio, ma i dati forse più interessanti dal punto di vista dell'efficacia sono quelli inerenti il miglioramento dei parametri ecocardiografici e la loro stabilità nel tempo. Infatti il gradiente valvolare medio scende da 52 mmHg iniziali a 9 mmHg dopo un mese rimanendo sostanzialmente invariato nei successivi controlli seriati a 3, 6 e 12
Tabella I : Dati ecocardiografici pre- e post-TAVI. LVMi: Left Ventricular Mass index; LVEF: Left Ventricular Ejection Fraction; LVEDV: Left Ventricular End Diastolic Volume; PAP: Pressione Arteriosa Polmonare.
Caratteristiche Base n=326 1 mese n=326 3 mesi n=326 6 mesi n=326 12 mesi n=188 p
Gradiente medio 52 ± 16 9 ± 5 9 ± 4 9 ± 4 10 ± 5 <0.0001
Gradiente di picco 84 ± 24 18 ± 8 17 ± 7 18 ± 7 19 ± 8 <0.0001
LVMi, g/m² 152 ± 38 142 ± 42 136 ± 43 132 ± 38 129 ± 35 <0.0001
LVEF, % 51 ± 13 54 ± 11 54 ± 12 55 ± 11 55 ± 10 <0.0001
LVEDV, mL 110 ± 41 112 ± 42 113 ± 43 109 ± 38 107 ± 43 <0.04
PAP, mmHg 42 ± 13 38 ± 12 38 ± 12 37 ± 11 38 ± 10 <0.0001
mesi; simili risultati sono descritti anche per il gradiente di picco aortico, frazione d'eiezione, pressione arteriosa polmonare, volume del ventricolo sinistro di fine diastole e Mass Index del ventricolo sinistro (vedi Tabella I). Tali miglioramenti si riflettono in maniera evidente nella sfera clinica dal momento che i pazienti risultavano in circa il 65% dei casi in classe NYHA I-II ad un mese dalla procedura con conferma ad un anno di follow-up, ribaltando di fatto il dato di base descritto all'arruolamento.
Questi risultati confermano quelli ottenuti da Piazza et al. [12] che su una coorte multicentrica di 646 pazienti con Logistic-EuroScore medio del 23% hanno raggiunto un successo procedurale pari al 97.2%, con netto miglioramento del gradiente trans valvolare (49.4 +/- 13.9 a 3 +/- 2 mmHg), registrando nella totalità dei pazienti un rigurgito paravalvolare di grado ?2. La mortalità a 30 giorni è stata dell'8% mentre il rate combinato di morte, stroke ed IMA rimaneva contenuto al 9.3%.
I dati provenienti da questi registri sono sostanzialmente simili e conferiscono un maggiore rilievo a quelli provenienti da popolazioni di studio meno ampie. Tra questi molto interessanti sono quelli di Rodés-Cabau et al. [13] in un registro di 339 pazienti sottoposti ad intervento di TAVI (49.6% con approccio trans femorale e 50.7% con approccio trans apicale) con successo procedurale del 93.3%. La mortalità procedurale, post-procedurale e cumulativa a 30 giorni era dell'1.7%, 8.7% e 10.4 % rispettivamente, e la sopravvivenza ad un anno era del 76% (maggior parte delle morti legata prevalentemente a cause extra-cardiache), in linea con i dati di altri studi. [14,15]
Inoltre veniva messo in evidenza come in condizioni quali l'aorta a porcellana e/o la fragilità aortica, non prese in considerazione negli scores utilizzati di routine nella stratificazione del rischio chirurgico, la TAVI sia un procedura assolutamente efficace e sicura dal momento che gli outcomes a breve e medio termine appaiono sovrapponibili a quelli della popolazione generale, ad eccezione della maggiore necessità di un secondo impianto valvolare spiegabile probabilmente con una iniziale malposizione della protesi da imputare alla difficoltà d'impianto e/o lo spostamento della stessa al momento del gonfiaggio del pallone causati da una aorta severamente calcifica. Altro dato interessante è che quest'ultimo gruppo di pazienti aveva un basso STS score.
Anche Godino et al. [16], nell'ambito di un lavoro più ampio, hanno studiato l'intervento TAVI eseguito in 16 pazienti con SA considerati "a basso rischio" sulla base dei valori di Logistic-EuroScore (<10%) ma inoperabili per altri motivi (aorta "a porcellana", cirrosi epatica in classe Child-Pugh C-D ecc.): l'approccio utilizzato per la procedura è stato transfemorale in 14 pazienti, in un paziente transapicale e in un altro transascellare. Nessuna morte è avvenuta nei primi 30 giorni e a 6 mesi la mortalità totale è stata del 12,5%.
La rilevanza di questo ultimi dati aumenta soprattutto se si considera come, ad oggi, la TAVI non sia raccomandata nei pazienti che semplicemente rifiutano la chirurgia in base ad una propria preferenza, e soprattutto come sia considerata ancora un'opzione "prematura" nei pazienti a basso rischio e quindi candidati all'intervento chirurgico. Non a caso le due protesi aortiche attualmente disponibili sul mercato sono state approvate esclusivamente per il trattamento della stenosi aortica severa ad elevato rischio chirurgico (Logistic-EuroSCORE ?20, STS-Score ?10). [17]
Questi risultati preliminari dovranno ovviamente essere confermati da casistiche più ampie ma non è utopistico pensare che la procedura di TAVI possa diventare una strategia consigliabile non solo a coloro che non possono sottoporsi a chirurgia (pazienti ad alto rischio) ma anche a pazienti operabili, riducendo i rischi correlati all'intervento cardiochirurgico quali le problematiche legate alla circolazione extracorporea i cui esiti non sempre sono lievi e reversibili (disturbi del linguaggio, paralisi motorie e diaframmatiche, ecc.), la prolungata degenza post operatoria, infezioni, suppurazione e guarigione ritardata della ferita chirurgica, la necessità di massive terapie trasfusionali o complicanze broncopolmonari che possono richiedere intubazione prolungata ed eventuale necessità di eseguire tracheotomia.
Un ulteriore registro canadese [18] ha selezionato 168 pazienti con area aortica mediana calcolata di 0.6 cm² ed oltre il 70% a rischio chirurgico elevato mentre la restante parte della popolazione era caratterizzata da aorta a porcellana (21.4%), obesità grave (9.1%), patologie polmonari allo stadio finale (9.1%), grave patologia epatica (6.8%) o multiple comorbidità debilitanti associati a fragilità, cachessia ed immobilità (34.1%) ovvero tutte quelle patologie escluse dall'Euro-Score e dall'STS-Score. Anche in questo lavoro il successo della procedura è stato raggiunto nel 94.1% dei casi e la mortalità globale era dell'11.3%, ma uno dei punti più importanti è quello che evidenzia come quest'ultimo dato passi da un comunque basso 14.3 % ad 8.3% negli interventi eseguiti temporalmente durante la seconda metà dello studio a conferma di come la curva di apprendimento tra gli operatori abbia una chiara accelerazione che si riflette sull'outcome dei pazienti. Peraltro la complessità dei pazienti nei due differenti periodi era assolutamente paragonabile. L'incidenza dei MACEs a 30 giorni era del 14.9%. Al netto miglioramento dei parametri ecocardiografici corrisponde un chiaro miglioramento della sintomatologia clinica già dopo un mese restando invariato ad un anno, e la sopravvivenza a 1, 12 e 24 mesi era rispettivamente 88.7%, 73.8% e 60.9%. Altro dato da sottolineare è che al follow-up mediano di 221 giorni e massimo 1111 giorni non è stato osservato nessun caso di deterioramento strutturale valvolare.
Una recente ed ampia revisione della letteratura [19] ha descritto la sicurezza ed efficacia della TAVI, confermando su una coorte complessiva di 1009 pazienti i dati fin qui descritti, ovvero un successo procedurale medio globale del 93.3% (range 86-100%) con un rate lievemente inferiore dopo approccio trans vascolare (89.2%) rispetto a quello trans apicale (97.3%). L'incidenza media di MACE è stata del 7.5% composta soprattutto da Stroke ed accidenti cerebrovascolari e la mortalità media combinata procedurale, postprocedurale e cumulativa in ospedale/30 giorni ha raggiunto l'11,4% (range 5.3-13.3%). Ad un anno la sopravvivenza media complessiva è stata del 75.9%, con una differenza non statisticamente significativa a favore dell'accesso trans vascolare rispetto a quello trans apicale (79.2% vs 73.6%) spiegabile, secondo gli Autori, con una prevalenza nel secondo gruppo di pazienti in condizioni cliniche più scadenti.
In nessuno degli studi inoltre veniva osservato deterioramento strutturale della valvola impiantata né altre disfunzioni protesiche di altra natura.
L'efficacia della procedura TAVI è stata ancora una volta confermata dal miglioramento della funzione valvolare e ventricolare, dei gradienti trans valvolari e della sintomatologia clinica sia immediatamente dopo la procedura che a distanza di 1 anno dalla stessa. Il rigurgito aortico era nel 78% dei casi assente o al massimo di grado 1 mentre solo nel 3.2% dei casi raggiungeva forme severe (grado 3). Un altro dato rilevante riguarda i tempi di degenza media in ospedale di 9.5 giorni di cui 2.7 in Unità di Terapia Intensiva, che sono un periodo di tempo notevolmente ridotto rispetto alle consuete degenze post-chirurgia. Infine il lavoro confermava i dati dello studio PARTNER per quanto riguarda la netta superiorità in termini di efficacia e sicurezza ad 1 anno della procedura TAVI rispetto al trattamento medico, evidenziando come i pazienti trattati con terapia medica avessero uno stato di salute iniziale sensibilmente migliore rispetto ai pazienti sottoposti a TAVI (Logistic-EuroScore 13.5 vs. 27.8%), ipotizzando così nel secondo gruppo un beneficio potenzialmente ancora maggiore rispetto a quanto descritto.
Nonostante l'indubbia affidabilità di questi risultati appare ovvio come la necessità maggiore sia quella di avere trials randomizzati con l'obiettivo di confrontare in maniera sistematica gli esiti dei pazienti dopo il trattamento con la valvola transcatetere e quelli seguenti la tradizionale chirurgia a cuore aperto. Recenti novità proprio in questo senso derivano dalla presentazione in anteprima, al VII Congresso europeo di geriatria "Healthy And Active Ageing For All Europeans" conclusosi a Bologna, dei risultati dello studio randomizzato e controllato PARTNER-Coorte A. [20]
I dati, ottenuti da 699 pazienti, dimostrano come la mortalità per qualunque causa riscontrata a 30 giorni dall´operazione sia del 3.4% con TAVI e 6.8% con l´intervento a cuore aperto. Stesso andamento dopo 12 mesi, in assenza di differenze statisticamente significative tra i pazienti sottoposti ai due diversi interventi, infatti 24.2% è la mortalità per qualunque causa ad 1 anno dalla TAVI, mentre è del 26.8% quella con intervento cardochirurgico tradizionale. La conferma di questi dati ad un follow-up più lungo e l'ampliamento della casistica, se non decisivi, potranno comunque garantire una solida base per l'apertura della procedura trans catetere ad un numero sempre maggiore di pazienti.
Rimane ovviamente intatta la "regola aurea" di non sottovalutare l'importanza della stratificazione del rischio che deve avvalersi del giudizio clinico-strumentale (gravità dei sintomi, aspettativa di vita, valutazione ecografica della severità della stenosi e delle caratteristiche valvolari) in combinazione con diversi scores quali il Logistic-EuroScore ed l'STS-Score. Occorre considerare limiti e controindicazioni all'approccio trans catetere legate alla grandezza dell'anulus aortico, alla presenza di valvole bicuspidi che possono impedire un adeguato impianto della protesi, a severe calcificazioni valvolari asimmetriche potenzialmente causa di ostruzione coronarica durante l'intervento, evento quest'ultimo che, avendo comunque bassa incidenza (<1%), si manifesta più frequentemente con l'utilizzo di valvola Edwards-SAPIEN; alla presenza di trombi cavitari in ventricolo sinistro; così come complicanze quali blocchi atrioventricolari che presentano un'incidenza del 4-8%, e che richiedono l'impianto di pacemaker nel 24% dei casi dopo utilizzo di CoreValve.
E' fondamentale optare per la miglior tecnica d'approccio, trans femorale o transapicale a seconda delle caratteristiche clinico-strutturali del paziente: le controindicazioni ad un accesso trans femorale sono la presenza di severe calcificazioni, eccessiva tortuosità, diametro ridotto, pregresso by-pass aorto-femorale a livello delle arterie iliache; aorta con eccessive angolazioni, severi ateromi dell'arco, coartazioni o aneurismi dell'aorta addominale con trombo murale protrudente; aterosclerosi "bulky" dell'aorta ascendente o dell'arco visualizzata con ecocardiografia trans esofagea. L'accesso trans apicale andrebbe evitato in caso di pregressi interventi chirurgici sul ventricolo sinistro che hanno previsto l'impianto di patch, con calcificazioni pericardiche, grave insufficienza respiratoria o con impossibilità nel raggiungere l'apice ventricolare. [17]
La selezione attenta del paziente, l'approccio più adeguato e l'esperienza degli operatori sono certamente gli elementi che possono garantire una sempre maggiore efficacia e sicurezza. A tal proposito alcuni reports [21,22] mostrano come il miglioramento della curva di apprendimento da parte degli operatori sia relativamente rapido e determini netti miglioramenti dei tassi di successo procedurale e di morte a 30 giorni, in coorti di pazienti assolutamente paragonabili dal punto di visto del rischio chirurgico, rendendo così sempre più rare ed evitabili complicanze maggiori come ictus, dissezione aortica, embolizzazioni di valvola, lesioni vascolari.
Inoltre i buoni risultati fin qui ottenuti aprono già oggi interessanti prospettive come le procedure valve-in-valve. E' noto come le bioprotesi aortiche, utilizzate durante approccio chirurgico tradizionale, siano soggette maggiormente a deterioramento nel tempo, con rischio di sviluppo di stenosi oppure insufficienza valvolare, rispetto alle valvole meccaniche. Il reintervento chirurgico in questi pazienti è legato spesso ad un elevato rischio operatorio: pazienti 80enni senza altre patologie presentano un rischio di mortalità che secondo l'STS-Score è del 5% per il reintervento su protesi aortica aumentando in maniera significativa in presenza di altre comorbidità. Così, l'impianto percutaneo di valvola (procedura denominata valve-in-valve) trova un'auspicabile indicazione anche in considerazione dei risultati soddisfacenti riportati nelle descrizioni dei primi limitati casi. [23,24]
Quanto descritto pone nuova luce sulle caratteristiche di minore invasività, recupero più rapido, riduzione della morbidità. oltre ad una migliore tolleranza psicologica, rispetto all'intervento chirurgico, in virtù del fatto che a parità di efficacia e sicurezza la procedura meno invasiva dovrebbe essere la prima scelta.
Allo stesso modo è innegabile che se il follow-up dei pazienti trattati con queste nuove bioprotesi percutanee continuerà ad essere favorevole senza andare incontro a degenerazione precoce della valvola (durata di almeno 10 anni) e se, conseguentemente, si manterrà nel tempo una limitata e clinicamente accetabile insufficienza aortica residua si può ipotizzare che il trattamento percutaneo diventerà la metodica di prima scelta anche in pazienti con stenosi aortica severa a basso rischio chirurgico e/o asintomatici.
Infatti, il perfezionamento continuo delle tecniche di approccio TAVI (transfemorale, transapicale e transascellare) e la disponibilità di nuovi device con profilo più basso e riposizionabili, molto probabilmente consentiranno di ottenere risultati ancora migliori in termini di efficacia e di sicurezza periprocedurale ed a medio/lungo termine.
BIBLIOGRAFIA
1. 2008 Focused Update Incorporated Into the ACC/AHA 2006 Guidelines for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 1998 Guidelines for the Management of Patients With Valvular Heart Disease): of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. Circulation 2008;118:e523-e661.
2. Ross J, Braunwald E. Aortic Stenosis. Circulation 968 Jul;38(1Suppl):61-7. Review
3. Spaccarotella C, Mongiardo A, Indolfi C. Pathophysiology of Aortic Stenosis and Approach to Treatment With Percutaneous Valve Implantation. Circulation Journal Vol.75, January 2011.
4. Iung B, Baron G, Butchart EG, et al. A prospective survey of patients with valvular heart disease in Europe: the Euro Heart Survey on valvular heart disease. Eur Heart J 2003;24:1231-43.
5. Iung B, Cachier A, Baron G, et al. Decision-making in elderly patients with severe aortic stenosis: why are so many denied surgery? Eur Heart J 2005;26(24):2714-20
6. Bach DS, Siao D, Girard SE, Duvernoy C, McCallister BD Jr, Gualano SK. Evaluation of patients with severe symptomatic aortic stenosis who do not undergo aortic valve replacement: the potential role of subjectively overestimated operative risk. Circ Cardiovasc Qual Outcomes 2009;2(6):533-9.
7. Otto CM, Mickel MC, Kennedy JW, Alderman EL, Bashore TM, Block PC, Brinker JA, Diver D, Ferguson J, Holmes DR Jr. Three-year outcome after balloon aortic valvuloplasty. Insights into prognosis of valvular aortic stenosis. Circulation. 1994;89:642-50.
8. Varadarajan P, Kapoor N, Bansal RC, Pai RG. Clinical profile and natural history of 453 nonsurgically managed patients with severe aortic stenosis. Ann Thorac Surg. 2006;82:2111-5.
9. Leon MB, Smith CR, Mack M, Miller DC, Moses JW, Svensson LG, Tuzcu EM, Webb JG, Fontana GP, Makkar RR, Brown DL, Block PC, Guyton RA, Pichard AD, Bavaria JE, Herrmann HC, Douglas PS, Petersen JL, Akin JJ, Anderson WN, Wang D, Pocock S; PARTNER Trial Investigators. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010 Oct 21;363(17):1597-607. Epub 2010 Sep 22
10. Eltchaninoff H, Prat A, Gilard M, Leguerrier A, Blanchard D, Fournial G, Iung B, Donzeau-Gouge P, Tribouilloy C, Debrux JL, Pavie A, Gueret P; Transcatheter aortic valve implantation: early results of the FRANCE (FRench Aortic National CoreValve and Edwards) registry. FRANCE Registry Investigators. Eur Heart J. 2011 Jan;32(2):191-7. Epub 2010 Sep 15.
11. Petronio AS, De Carlo M, Bedogni F, et al. Safety and efficacy of the subclavian approach for transcatheter aortic valve implantation with the CoreValve Revalving System. Circ Cardiovasc Interv 2010;3:359-66.
12. Piazza N, Grube E, Gerckens U, den Heijer P, Linke A, Luha O, et al. Procedural and 30-day outcomes following transcatheter aortic valve implantation using the third generation (18 Fr) corevalve revalving system: results from the multicentre, expanded evaluation registry 1-year following CE mark approval. EuroIntervention. 2008;4:242-9.
13. Rodés-Cabau J, Webb JG, Cheung A, Ye J, Dumont E, Feindel CM, et al. Transcatheter aortic valve implantation for the treatment of severe symptomatic aortic stenosis in patients at very high or prohibitive surgical risk: acute and late outcomes of the multicenter Canadian experience.J Am Coll Cardiol. 2010;55:1080-90.
14. Himbert D, Descoutures F, Al-Attar N, et al. Results of transfemoral or transapical aortic valve implantation following a uniform assessment in high-risk patients with aortic stenosis. J Am Coll Cardiol 2009;54: 303-11.
15. Webb JG, Altwegg L, Boone R, et al. Transcatheter aortic valve implantation. Impact on clinical and valve-related outcomes. Circulation 2009;119:3009 -16.
16. Godino C, Maisano F, Montorfano M, Latib A, Chieffo A, Michev I, Al-Lamee R, Bande M, Mussardo M, Arioli F, Ielasi A, Cioni M, Taramasso M, Arendar I, Grimaldi A, Spagnolo P, Zangrillo A, La Canna G, Alfieri O, Colombo A. Outcomes after transcatheter aortic valve implantation with both Edwards-SAPIEN and CoreValve devices in a single center: the Milan experience. JACC Cardiovasc Interv. 2010 Nov;3(11):1110-21.
17. Vahanian A, Alfieri O, Nawwar AA, Antunes M, Bax J, Cormier B, Cribier A, De Jaegere P, Fournial G, Kappetein AP, Kovac J, Ludgate S, Maisano F, Moat N, Mohr F, Nataf P, Pie´rard L, Pomar JL, Schofer J, Tornos P, Tuzcu M, van Hout B, Von Segesser LK, Walther T. Transcatheter valve implantation for patients with aortic stenosis: a position statement from the European Association of Cardio-Thoracic Surgery (EACTS) and the European Society of Cardiology (ESC), in collaboration with the European Association of Percutaneous Cardiovascular Interventions (EAPCI). European Heart Journal (2008) 29, 1463-1470.
18. Webb JG, Altwegg L, Boone RH, Cheung A, Ye J, Lichtenstein S, Lee M, Masson JB, Thompson C, Moss R, Carere R, Munt B, Nietlispach F, Humphries K. Transcatheter aortic valve implantation: impact on clinical an valve-related outcomes. Circulation 2009; 119:3009-16.
19. Figulla L, Neumann A,Figulla HR, Kahlert P, Erbel R, Neumann T. Transcatheter aortic valve implantation: evidence on safety and efficacy compared with medical therapy. A systematic review of current literature. Clin Res Cardiol (2011) 100:265-276.
20. VII Congresso Europeo di Geriatria "Healthy And Active Ageing For All Europeans". Bologna 2011.
21. Walther T, Simon P, Dewey T, Wimmer-Greinecker G, Falk V, Kasimir MT, et al. Transapical minimally invasive aortic valve implantation: multicenter experience. Circulation. 2007;116:I240-5.
22. Himbert D, Descoutures F, Al-Attar N, Iung B, Ducrocq G, Détaint D, et al. Results of transfemoral or transapical aortic valve implantation following a uniform assessment in high-risk patients with aortic stenosis.J Am Coll Cardiol. 2009;54:303-11.
23. Wenaweser P, Buellesfeld L, Gerckens U, Grube E. Percutaneous aortic valve replacement for severe aortic regurgitation in degenerated bioprosthesis: The first valve in valve procedure using the corevalve revalving system. Catheter Cardiovasc Interv 2007;70(5):760-4.
24. Ussia G, Barbanti M, Tamburino C. Treatment of severe regurgitation of stentless aortic valve prosthesis with a self-expandable biological valve. J Invasive Cardiol 2009 Mar;21(3):E51-4.