Cardiorete 2011
Menu principale:
- Home Page
- Gregorio
- Rosato
- Boccanelli
- Simonetti
- Bovenzi
- Tozzi
- Caldarola
- Gnarra
- Giudice
- Palermo
- Capomolla
- Progetto Cardio
- Longobardi
- Santoro M.
- Citro
- Capuano
- Riccio
- Mazzuoli
- Severino
- Santomauro
- Caso
- Miceli
- Gallo
- Sibilio
- Scardovi
- Ravera
- Aloia
- Murena
- Citera
- Elia
- Viceconti
- Ardissino
- Scardi
- Violini
- Perna
- Di Benedetto
- Baldi
- Panza
- Piazza
- Piscione
- Silvestri
- Di Gregorio
- Cillo
- Campana
- Mascia
- Ducceschi
- Tedesco
- Bellizzi
- Oltrona Visconti
- Merlini
- D'Angelo
- Gabrielli
- Santoro
- Gulizia
- Meucci
- Salerno
Caso
ATRIO SINISTRO ED EVENTI EMBOLICI
Pio Caso, Massimo Cavallaro, Lugi Nunziata**, Ilaria Caso**, Alfonso R. Martiniello*, Fortunato Arenga ,Salvatore Comenale Pinto, Sergio Padula*, Ciro Cavallaro, Sergio Severino*
UOC di Cardiologia,Presidio Monaldi, Dipartimento di Cardiologia,
* UOSD di Diagnostica non Invasiva, Presidio Monaldi Dipartimento di Cardiologia,
**UOC di Cardiologia ,Presidio Cotugno,Dipartimento di Cardiologia
***Cattedra di Cardiologia,Seconda Univ. di Napoli, Azienda Ospedaliera dei Colli, Napoli
L' Ictus rappresenta una delle più importanti cause di morte e di disabilità a lungo termine a livello mondiale, in particolare l' ictus ischemico rappresenta il 90% dei casi1,2. La causa più frequente di ictus ischemico è l' aterosclerosi dei vasi cervicali e cranici, l' embolia di origine cardiaca è responsabile del 15-30% dei casi2,3. In un altro 30% di casi di ictus ischemico non è possibile determinarne l' eziologia4, ma la caratteristiche cliniche nella maggioranza di questi casi ne suggeriscono una causa embolica5. L' ictus cardioembolico, inoltre è gravato da una prognosi peggiore, con una mortalità del 50% a tre anni6
Fisiopatologia: l' encefalo riceve il 15% della gittata cardiaca ed è particolarmente sensibile al danno da ischemia. Così, materiale embolico proveniente dal cuore frequentemente raggiunge le arterie cervico-cefaliche, provocandone l' occlusione. Nella maggior parte dei casi gli emboli sono costituiti da trombi7, la cui tendenza alla dissoluzione spontanea può portare ad una evoluzione emorragica dell' ictus ischemico8. Di solito i tromboemboli occludono i tronchi delle arterie cerebrali o loro diramazioni maggiori7, mentre microemboli di materiale quale aria, grasso o cristalli di colesterolo tendono a raggiungere i piccoli rami arteriosi terminali, dando luogo ai cosiddetti infarti lacunari9.
Quadro Clinico: I dati obiettivi ed anamnestici non permettono di differenziare con certezza l' ictus cardioembolico dalle altre cause di ischemia cerebrale10. Di norma l' ictus cardioembolico è caratterizzato da deficit neurologici che raggiungono la massima intensità già all' esordio della sintomatologia, riflettendo l' improvvisa interruzione del flusso ematico cerebrale10. Ciò di solito non si osserva nell' ictus ateroembolico, in cui il decorso dei deficit neurologici tende ad essere più graduale11. La caratteristica più specifica, anche se poco sensibile, degli eventi cardioembolici cerebrali è la presenza di infarti in diversi territori associata ad embolia sistemica10,12.
Diagnosi: La diagnosi di ictus cardioembolico viene effettuata quando vi è evidenza di una fonte cardiaca di embolia associata a caratteristiche cliniche, laboratoristiche e di neuroimaging tipiche. Nella maggioranza dei casi gli emboli hanno origine a livello atriale o dal tessuto valvolare, in particolare le fonti cardioemboliche sono suddivise in condizioni definite ad alto rischio: fibrillazione atriale, malattia del nodo del seno, flutter atriale, stenosi mitralica, cardiomiopatia dilatativa, infarto miocardico acuto, tumori cardiaci, endocardite, protesi valvolari; e condizioni a rischio definito medio o incerto: pervietà del forame ovale, difetto interatriale, aneurisma del setto interatriale, presenza di ecocontrasto spontaneo, prolasso valvolare mitralico, calcificazioni valvolari mitraliche e valvular strands (filamenti di fibrina adesi all' endotelio valvolare).
Ecocardiografia: L' ecocardiografia ,oggi, in particolare l' ecocardiografia transesofagea (TOE) viene utilizzata come esame diagnostico di routine per indagare l' origine di eventi ischemici cerebrali13. L' eco transtoracico è in grado di identificare la presenza di una fonte cardioembolica nel 25% dei pazienti con manifestazioni cliniche evidenti di cardiopatia, in assenza di un quadro clinico suggestivo la sensibilità del TTE è ridotta al 10%14.
D' altra parte l' eco trans-esofageo ha invece una sensibilità del 50% nel diagnosticare fonti cardiache di embolia, indipendentemente dalla presenza clinicamente evidente di cardiopatia14. Inoltre la TOE consente anche di diagnosticare un origine aortica di emboli, quale l' Ateroma aortico "complesso", che è rappresentato da una placca ulcerata, mobile, protrudente nel lume del vaso15, ed è l' esame diagnostico con la migliore sensibilità per specifiche patologie emboligene quali: trombi atriali sinistri, ecocontrasto spontaneo in atrio sinistro, pervietà del forame ovale e filamenti adesi alle valvole (valvular strands)16.
In tempi più recenti grazie all' innovazione tecnologica l' accuratezza diagnostica dell' eco transtoracico si è avvicinata a quella del transesofageo nella ricerca di shunt interatriali destro-sinistro, raggiungendo grazie all' introduzione della seconda armonica livelli di sensibilità per la diagnosi di pervietà del forame ovale, che variano dal 62,5% al 90%, confrontati con l' eco transesofageo17,18.
Vi sono comunque scarsi dati riguardo l' approccio diagnostico ecocardiografico ottimale da utilizzare nei pazienti con ischemia cerebrale, ma comunque il TTE è più utile come tecnica di imaging di prima istanza per i pazienti con manifestazioni cliniche franche di cardiopatia. Al contrario la più alta prevalenza di cause emboligene di difficile diagnosi all' eco transtoracico nei pazienti giovani con ictus criptogenetico rende l' eco transesofageo la metodica di scelta in questa categoria di pazienti. Una altra metodica da prendere in considerazione nella diagnosi di shunt intratriali è il Doppler transcranico, che ha dimostrato valore diagnostico comparabile con l' eco transesofageo in tali casi, ma non può fornire informazioni dirette riguardo l' anatomia cardiaca.
Condizioni ad alto rischio. Fibrillazione atriale: la fibrillazione atriale costituisce la causa più frequente di ictus cardioembolico, la sua importanza è dovuta all' elevata prevalenza, soprattutto nei soggetti anziani (0,4-1% nella popolazione generale, fino a 9% fra i soggetti di età superiore agli 80 anni)19. La fibrillazione atriale secondaria a valvulopatia è associata a un rischio maggiore di tromboembolia. Il rischio embolico è simile sia nei casi di fibrillazione atriale parossistica sia per la fibrillazione atriale cronica, ma risulta influenzato dalla presenza di determinati fattori di rischio, quali: ipertensione arteriosa, diabete, età superiore ai 75 anni, disfunzione sistolica del ventricolo sinistro o pregressi episodi ischemici cerebrali (TIA o ictus)20.
Questi fattori di rischio vengono presi in considerazione dal CHADS2 score per la stratificazione del rischio embolico, in cui 1 punto viene assegnato a ciascun fattore di rischio e 2 punti vengono assegnati in caso di ictus o TIA pregresso. Un punteggio di rischio superiore a due identifica i pazienti ad alto rischio che necessitano di terapia anticoagulante21,22. L' ecocardiografia, nella fibrillazione atriale, è utile per l' identificazione di trombi intratriali, per la valutazione del rischio di tromboembolico e nel guidare la procedura di cardioversione elettrica13. La TOE è considerata il gold standard per la ricerca di trombi, in quanto permette una ottimale visualizzazione dell' auricola sinistra, che rappresenta la sede più frequente di trombosi nei soggetti fibrillanti. I trombi hanno l' aspetto di masse ecoriflettenti (Fig.1), distinte dall' endocardio sottostante, visibili in più sezioni e non correlate ai muscoli pettinati23.
La TOE, inoltre, è in grado di identificare alterazioni della funzione atriale sinistra che precedono la formazione di trombi, quali la presenza di ecocontrasto spontaneo e basse velocità di svuotamento dell' auricola al Doppler Pulsato (inferiori a 30-40 cm/sec)30. Studi recenti hanno dimostrato che il TTE attraverso l' utilizzo della seconda armonica permette in un buon numero di pazienti lo studio della funzione auricolare mediante l' M-mode o il Doppler pulsato24,25.
Lo studio dell' auricola sinistra al transesofageo, quindi, è utile per la stratificazione prognostica del rischio embolico nel paziente fibrillante, i fattori di rischio ad oggi identificati comprendono la presenza di trombi, la presenza di ecocontrasto spontaneo e velocità di svuotamento dell' auricola inferiori a 20 cm/sec (Fig.2)23, altri fattori di rischio ecocardiografici sono la presenza di Ateroma aortico complesso a livello dell' arco aortico alla TOE e disfunzione sistolica del ventricolo sinistro con FE<35% . La TOE viene utilizzata per guidare la tempistica della cardioversione elettrica e l' eventuale necessità di terapia anticoagulante pre-cardioversione, con l' approccio TOE guidato33, l' assenza di trombi pre-cardioversione consente di evitare il periodo di trattamento con warfarin nelle 3 settimane precedenti la cardioversione, l' eventuale presenza di trombi rende necessaria la terapia anticoagulante di almeno 3 settimane, al termine della quale viene nuovamente eseguito transesofageo e in assenza di trombi può essere praticata la cardioversione13,26, in alternativa il paziente con trombi intratriali può essere destinato a permanere in fibrillazione atriale attuando una terapia di controllo della frequenza associata a terapia anticoagulante per il resto della vita.
Una alternativa alla terapia farmacologica per la profilassi della trombosi è la chiusura percutanea mediante device dell' auricola sinistra, che si è dimostrata non inferiore alla terapia anticoagulante orale27. L' ecocardiografia è utile anche nella previsione del mantenimento del ritmo sinusale a lungo termine post-cardioversione. La presenza di alte velocità in auricola23 al TOE, di dimensioni atriali sinistre non aumentate28 e di buone proprietà di deformazione allo strani imaging dell' atrio sinistro29-31 sono indici prognostici favorevoli per il mantenimento del ritmo sinusale. Altre aritmie atriali che possono causare tromboembolia sistemica sono il flutter atriale e la sick sinus syndrome, in questi casi il rischio embolico è generalmente inferiore alla fibrillazione atriale e meno studiato, per il flutter il trattamento anticoagulante non differisce da quello utilizzato per la fibrillazione atriale.
Tumori cardiaci: I tumori cardiaci sono responsabili di un piccolo numero di eventi tromboembolici cerebrali14. Il mixoma è il più comune, rappresentando il 50% dei tumori cardiaci benigni32, il fibroelastoma papillare rappresenta un altro 30% dei casi33. I mixomi nella quasi totalità dei casi sono localizzati in atrio sinistro, in particolare ,a livello della fossa ovale, di solito all' ecocardiogramma hanno l' aspetto di masse dotate di un peduncolo mediante il quale aderiscono alla parete atriale (Fig.3).
L' embolia periferica è una complicanza che si verifica nel 30-40% dei casi, in genere si tratta dei tumori con aspetto polipoide e mixoide, a superficie irregolare. La TTE è di solito sufficiente per lo studio di queste lesioni, i mixomi possono essere confusi con trombi, ma la caratteristica localizzazione ne orienta la diagnosi. I fibroelastomi papillari sono comunemente associati al tessuto valvolare, di solito sono di piccole dimensioni, con diametro compreso fra 0,5 e 2cm, per queste caratteristiche possono essere confusi con vegetazioni valvolari, la diagnosi differenziale ecocardiografica può essere difficile, è utile considerare anche il quadro clinico e ricercare la presenza di segni e sintomi di infezione sistemica.
Di solito questi tumori appaiono come piccole masse di forma irregolare, attaccate mediante un sottile peduncolo alla superficie valvolare, la mobilità del tumore è il più importante fattore di rischio di morte o embolia non fatale. Il trattamento più indicato per la prevenzione secondaria di ictus ischemico nel caso del mixoma o di fibroelastomi di grandi dimensioni e molto mobili è la rimozione chirurgica del tumore4,32,33.
Protesi Valvolari: L' embolia sistemica è una complicanza che interessa sia le protesi meccaniche, sia le protesi biologiche, con una frequenza dell' 1-4% eventi all' anno34, l' 80% degli eventi tromboembolici associati a protesi valvolari interessa l' encefalo, il rischio assoluto di embolia è maggiore per le protesi in sede mitralica (2-3,5% all' anno), rispetto alle protesi aortiche (1-2%)34.
Il rischio è maggiore nel periodo post-operatorio, per l' interruzione della terapia anticoagulante ed in gravidanza35. Sia la TTE e sia la TOE sono utili per la diagnosi, due modalità di presentazione clinico-ecocardiografica sono possibili, trombosi severamente ostruttiva con disfunzione della protesi valvolare o trombosi parziale con ostruzione di lieve entità o assente.
La trombosi con ostruzione della protesi produce al TTE un alto gradiente transvalvolvolare, anomalo jet al color-Doppler e ridotta area effettiva dell' orifizio valvolare. Alla TTE in alcuni casi può essere direttamente visualizzato il trombo, ma la metodica di scelta per la diagnosi in caso di trombosi su valvola protesica è l' ecocardiografia transesofagea35, in quanto può evidenziare la presenza di reperti indicativi quali: ridotta escursione degli elementi mobili, rigurgito anomalo centrale, perdita del wash-out fisiologico delle valvole meccaniche; talora alla TOE è possibile la diretta visualizzazione del trombo. Il rischio di embolia risulta essere direttamente correlato alle dimensioni del trombo36.
Fig. 1- Eco-transesofageo con evidenza di trombo in auricola sinistra
Fig.2- Velocità di flusso in Auricola sinistra al Doppler Pulsato,
registrate durante eco-transesofageo di un soggetto fibrillante,
notare i valori inferiori delle velocità di flusso.
Fig. 3-Eco-transesofageo, mixoma in atrio sinistro adeso alla parete del setto interatriale.
Fig.4- Flussimetria Doppler basale dell' arteria cerebrale media ottenuta da finestra trans-temporale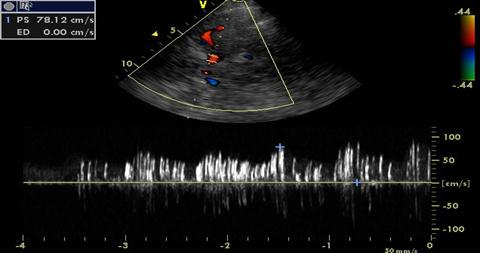
Fig.4- Flussimetria Doppler basale dell' arteria cerebrale media ottenuta da finestra trans-temporale
Fig. 5
Campionamento dell'arteria cerebrale media ottenuto da finestra trans
temporale con infusione di soluzione fisiologica agitata.. In caso di presenza di forame
ovale pervio, entro tre cicli si evidenzia effetto di rumore Doppler dovuto al passaggio
di bolle attraverso il PFO.
Nel caso di trombosi parziale su valvola protesica la TTE di solito non mostra evidenti alterazioni e la metodica di scelta è la TOE. La prevenzione con terapia anticoagulante nel caso dei pazienti portatori di protesi meccanica prevede il mantenimento di un range di INR compreso fra 2,5 e 3,5 e nel caso i valori di INR siano già in questo range terapeutico è utile l' aggiunta di aspirina a basse dosi per i pazienti portatori di protesi meccanica2,34. Per i pazienti portatori di protesi biologiche può essere considerato un range terapeutico dell' INR fra 2 e 32.,34.
Endocardite e vegetazioni valvolari: L' embolia sistemica è una importante complicanza dell' endocardite, si verifica con una frequenza del 15-20% dei casi37, il rischio è più alto nei primi 7-10 giorni dall' esordio dei sintomi e l' interessamento della mitrale comporta il maggior rischio di embolia sistemica38.
Il sospetto di endocardite in un soggetto con evidenza di embolia sistemica è posto in base alla presenza di febbre, soffio di nuova insorgenza e segni clinici tipici, e viene confermato all' ecocardiografia trans-toracica o transesofagea. In alcuni casi l' embolia sistemica può essere la prima manifestazione dell' endocardite, che può essere diagnosticata mediante transesofageo in soggetto con embolia sistemica da causa sconosciuta.
L' ecocardiografia oltre che per la diagnosi è utile per la valutazione del rischio embolico, che è correlato alle dimensioni delle vegetazioni valvolari, alla loro mobilità, all' estensione e alla consistenza38,39. Il trattamento è diretto alla causa dell' embolia sistemica e comprende essenzialmente la terapia antibiotica dell' endocardite e se indicato l' intervento chirurgico37. Vegetazioni valvolari di natura non infettiva possono essere presenti in diverse patologie sistemiche, quali ad esempio neoplasie, AIDS, o malattie autoimmuni e sono collegate ad un alto rischio di embolia sistemica40,41. Il trattamento è specifico per le diverse forme di endocardite non infettiva e comprende terapia antineoplastica, farmaci antiretrovirali e immunosoppressivi, associati a terapia anticoagulante, in genere con eparina34.
Condizioni a rischio medio o incerto: Pervietà del forame ovale (PFO) ed Aneurisma del setto interatriale. La PFO è presente nel 25-30% dei soggetti adulti42 e rappresenta il residuo della comunicazione interatriale presente in età fetale, ha la forma di una fessura, delimitata dal versante atriale destro dal septum secundum e dal versante atriale sinistro dal septum primum, di norma tale comunicazione dopo la nascita è mantenuta chiusa per l' elevata pressione atriale sinistra che tende ad accollare le due componenti del setto interatriale.
Un aumento della pressione atriale destra, come durante manovra di Valsalva o per ipertensione polmonare può provocare uno shunt destro-sinistro a livello del PFO. Esistono diverse varianti anatomiche e funzionali di PFO, che variano da forme con minimo shunt, come quella descritta in precedenza, ed è la più comune, a forme più rare con comunicazione interatriale permanente e prevalente shunt sinistro-destro con occasionale inversione.
Diversi studi43-46, anche se non tutti47,48 quelli compiuti sull' argomento hanno dimostrato una associazione fra PFO ed ictus ischemico, in particolare fra i soggetti con età inferiore ai 55 anni ed ictus criptogenetico, nei quali la prevalenza del PFO arriva fino al 50%. Il meccanismo proposto è quello dell' embolia paradossa49, si basa sul riscontro ecocardiografico di alcuni casi di trombo "in transito" attraverso la PFO. In pazienti con embolia sistemica il riscontro contemporaneo di trombosi venosa e PFO è sufficiente per porre diagnosi di embolia paradossa49. Il Doppler transcranico può porre il sospetto di shunt a livello di un PFO, mediante il riscontro di microbolle nel circolo cerebrale immediatamente dopo iniezione endovenosa di soluzione salina agitata (Fig. 4 e 5).
La diagnosi di PFO generalmente richiede una TOE, con iniezione di microbolle o mezzo di contrasto e la visualizzazione diretta del passaggio dall' atrio destro all' atrio sinistro attraverso il forame ovale, sia spontaneamente sia dopo manovra di Valsalva o colpo di tosse, lo shunt può essere evidenziato anche mediante color Doppler. Il numero di bolle che passano attraverso il difetto dall' atrio destro all' atrio sinistro rappresenta una stima dell' entità dello shunt. Talvolta lo shunt può essere evidenziato anche alla TTE. L' Aneurisma del setto interatriale è rappresentato da una esagerata escursione o una deviazione fissa del setto interatriale, nella regione della fossa ovale, verso l' atrio sinistro o destro o entrambi, la diagnosi si pone quando la deviazione del setto interatriale è superiore a 1cm dalla linea immaginaria che congiunge il setto interventricolare basale e la porzione superiore del setto interatriale.
L' aneurisma del setto interatriale è stato riscontrato con maggiore frequenza nei soggetti colpiti da ictus ischemico rispetto alla popolazione generale (7,9% contro 2,2%)50, i meccanismi patogenetici proposti alla base dell' ictus ischemico sono la presenza di shunt interatriale, presente in una proporzione dal 50 al 90% dei soggetti con aneurisma del setto interatriale42, la trombosi in situ51 o aritmie associate52. Le diverse opzioni terapeutiche sono rappresentate dalla terapia antiaggregante con aspirina a basse dosi, la terapia anticoagulante e la chiusura percutanea dello shunt interatriale, secondo le linee guida non vi sono sufficienti evidenze per elaborare raccomandazioni specifiche riguardo il trattamento medico o interventistico2,4.
Data l' elevata prevalenza di PFO nella popolazione generale, in assenza di caratteristiche cliniche o anatomiche ad alto rischio, cioè la presenza di aneurisma del setto interatriale associato a shunt di importante entità, non è possibile trarre conclusioni riguardo la patogenicità e il rischio di ictus ischemico nel singolo paziente. Pertanto nei soggetti affetti da PFO la terapia antiaggregante con aspirina a basse dosi è preferibile in prima istanza, in assenza di stati di ipercoagulabilità accertati o evidenza di tromboembolia venosa, che pongono indicazione per il trattamento anticoagulante.
Nel caso dell' ictus criptogenetico associato a PFO con shunt di entità importante, con passaggio di più di 50 microbolle, aneurisma del setto interatriale o infarti multipli, va iniziata terapia anticoagulante a lungo termine, la chiusura del PFO mediante procedura per cutanea può essere una alternativa qualora sia controindicata la terapia anticoagulante o per i soggetti giovani per i quali può essere preferita in luogo di un trattamento con dicumarolici a lungo termine. Per la prevenzione secondaria di ictus ischemico nei pazienti con aneurisma del setto interatriale non vi sono ad oggi in letteratura precise indicazioni.
Prolasso valvolare mitralico. Alcuni studi nei primi anni 80, hanno riportato una associazione fra il prolasso della valvola mitrale e l' ischemia cerebrale nei soggetti di età inferiore ai 45 anni53, ciò probabilmente era dovuto al fatto che i criteri e le tecniche ecocardiografiche utilizzate portavano ad una sovrastima della prevalenza del prolasso mitralico, studi più recenti dotati di maggiore specificità per la diagnosi di prolasso hanno fallito nel dimostrare tale associazione54,55.
Altri studi suggeriscono la presenza di degenerazione mixomatosi e di aritmia sopraventricolari come fattori di rischio per ictus ischemico in questi pazienti, uno studio prospettico condotto su 343 soggetti affetti da prolasso della mitrale solo 2 (0,6%) hanno riportato un evento ischemico cerebrale56, e il rischio di ictus ischemico è considerato molto basso, stimato a 1 evento ogni 6000 pazienti ogni anno57. Le linee guida non raccomandano per la prevenzione secondaria la terapia anticoagulante nei portatori di prolasso isolato2,4,65, eccetto nel caso in cui sia presente insufficienza valvolare58.
Calcificazioni valvolari: Le calcificazioni dell' annulus mitralico e la sclerosi delle cuspidi aortiche sono associate ad un maggiore rischio di malattia aterosclerotica a carico dei vasi59,60. Alcuni studi prospettici hanno dimostrato un aumento dell' incidenza di ictus ischemico nei soggetti con calcificazioni dell' annulus mitralico61, una simile associazione è stata dimostrata per la sclerosi valvolare aortica, nel caso in cui sia presente anche stenosi valvolare62.
L' associazione di eventi cerebrovascolari e calcificazioni dell' annulus mitralico può riflettere lo status di marker di aterosclerosi dei depositi valvolari di calcio, ma alcuni studi riportano un possibile ruolo causale diretto come fonte di emboli di materiale calcifico o trombotico59. Le linee guida, riconoscendo la scarsità di dati raccomandano differenti strategie terapeutiche a seconda che il materiale embolico sia costituito da calcio o da trombo, nel tale caso è raccomandata la terapia con anticoagulanti orali2,34.
Valvular strands: Queste formazioni sono filamenti mobili costituiti da accumuli endotelizzati di fibrina in corrispondenza di microlesioni dell' endotelio che riveste le valvole63. E' stata riportata una associazione fra la presenza di tali formazioni e ictus ischemico63, ma studi longitudinali non hanno confermato questo dato64-66. In questi pazienti data la dubbia associazione causale fra le lesioni valvolari e l' ictus ischemico la terapia anticoagulante non è consigliata per la prevenzione secondaria ed è preferita la terapia con aspirina a basse dosi4.
Conclusioni: La diagnosi di ictus cardioembolico poggia sul ritrovamento di potenziali fonti emboliche cardiache in assenza di altre cause possibili di ischemia cerebrale. L' ecocardiografia transesofagea rappresenta l' esame di imaging più utile per l' individuazione di fonti cardiache di embolia, in particolare per quanto riguarda le embolie di origine atriale. Le raccomandazioni circa il trattamento sono meglio definite per la condizioni ad alto rischio, mentre per le condizioni a rischio medio o incerto ad oggi non vi sono indicazioni univoche in letteratura.
BIBLIOGRAFIA
1. Doufekias E, Segal AZ, Kizer JR. Cardiogenic and Aortogenic Brain Embolism. J Am Coll Cardiol 2008; 51:1049-59
2. Sacco RL, Adams R, Albers G, et al. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack. Stroke 2006;37:577- 617.
3. Goldstein LB, Adams R, Alberts MJ et al. Primary prevention of ischemic stroke: a Guideline from the American Heart association/American Stroke Association Stroke Council. Stroke 2006;37:1583-633.
4. Albers GW, Amarenco P, Easton JD, et al. Antithrombotic and thrombolytic therapy for ischemic stroke. Chest 2004;126:483S-512S
5. Kistler JP. Cerebral embolism. Compr Ther 1996;22:515-30.
6. De Jong G, van Raak L, Kessels F, Lodder J. Stroke subtype and mortality: a follow-up study in 998 patients with a first cerebral infarct. J Clin Epidemiol 2003;56:262-68.
7. Marder VJ, Chute DJ, Starkman S, et al. Analysis of thrombi retrieved from cerebral arteries of patients with acute ischemic stroke. Stroke 2006;37:2086 -93.
8. Moulin T, Crepin-Leblond T, Chopard JL, Bogousslavsky J. Hemorrhagic nfarcts. Eur Neurol 1994;34:64 -77.
9. Momjian-Mayor I, Baron JC. The pathophysiology of watershed infarction in internal carotid artery disease: review of cerebral perfusion studies. Stroke 2005;36:567-77.
10. Kittner SJ, Sharkness CM, Price TR, et al. Infarcts with a cardiac source of embolism in the NINCDS Stroke Data Bank: historical features. Neurology 1990;40:281- 4.
11. Arboix A, Oliveres M, Massons J et al. Early ifferentiation of cardioembolic from atherothrombotic cerebral infarction: multivariate analysis. Eur J Neurol 1999;6:677- 83.
12. Bogousslavsky J, Cachin C, Regli F et al. Cardiac sources of embolism and cerebral infarction-clinical consequences and vascular concomitants: the Lausanne stroke registry. Neurology 1991;41:855-9.
13. Pepi M, Evangelista A, Nihoyannopoulos P, et al. Recommendations for echocardiography use in the diagnosis and management of cardiac sources of embolism. European Association of Echocardiography (EAE). European Journal of Echocardiography 2010; 11: 461-476.
14. Rahmatullah AF, Rahko PS, Stein JH. Transesophageal echocardiography for the evaluation and management of patients with cerebral ischemia. Clin Cardiol 1999;22:391- 6.
15. The Stroke Prevention in Atrial Fibrillation Investigators Committee on Echocardiography. Transesophageal echocardiographic correlates of thromboembolism in high-risk patients with nonvalvular atrial fibrillation. Ann Intern Med 1998;128:639-47.
16. Cheitlin MD, Armstrong WF, Aurigemma GP, et al. ACC/AHA/ ASE 2003 guideline update for the clinical application of echocardiography: summary article.. J Am Coll Cardiol 2003;42:954 -70.
17. Ha JW, Shin MS, Kang S, et al. Enhanced detection of right-to-left shunt through patent foramen ovale by transthoracic echocardiography using harmonic imaging. Am J Cardiol 2001;87:669 -71.
18. Souteyrand G, Motreff P, Lusson JR, et al. Comparison of transthoracic echocardiography using second harmonic imaging, transcranial Doppler and transesophageal echocardiography for the detection of patent foramen ovale in stroke patients. Eur J Echocardiogr 2006;7: 147-54.
19. Go AS, Hylek EM, Phillips KA et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001;285:2370-5.
20. Hart RG, Halperin JL. Atrial fibrillation and stroke. Stroke 2001; 32:803- 8.
21. Gage BF, Waterman AD, Shannon W, Boechler M, Rich MW, Radford MJ. Validation of clinical classification schemes for predicting stroke. Results from the National Registry of Atrial Fibrillation. JAMA 2001;285:2864 -70.
22. Camm AJ, Kirchhof P, Lip GYH, et. al. Guidelines for the management of atrial Fibrillation. The Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J. 2010 Oct;31(19):2369-429.
23. Fatkin D, Kuchar DL, Thorburn CW, et al. Transesophageal echocardiography before and during direct current cardioversion of atrial fibrillation: evidence for atrial stunning as a mechanism of thrombo-embolic complications. J Am Coll Cardiol 1994;23:307-16.
24. De Luca I, Colonna P, Sorino M, et al. New monodimensional transthoracic echocardiographic sign of left atrial appendage function. J Am Soc Echocardiogr 2007;20:324-32.
25. Moreira FC, Miglioransa MH, Hartmann IB, et al. Left atrial appendage assessment by second harmonic transthoracic echocardiography after an acute ischemic neurologic event. J Am Soc Echocardiogr 2005;18:206-12.
26. Klein AL, Grimm RA, Murray RD, Apperson-Hansen C, Asinger RW, Black IW et al., for the Assessment of Cardioversion Using Transesophageal Echocardiography Investigators. Use of transesophageal ecocardiography to guide cardioversion in patients with atrial fibrillation. N Engl J Med 2001;344:1411-20.
27. Holmes DR, Reddy VY, Turi ZG, Doshi SK, Sievert H, Buchbinder M, Mullin CM, Sick P. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised noninferiority trial. Lancet 2009;374:534-542.
28. Shin AH, Park MY. Left atrial volume is a predictor of atrial fibrillation recurrence after catheter ablation. J Am Soc Echo 2008;21:697-702.
29. Di Salvo G, Caso P, Lo Piccolo R, Fusco A, Martiniello AR, Russo MG et al. Atrial myocardial deformation properties predict maintenance of sinus rhythm after external cardioversion of recent-onset one atrial fibrillation: a color Doppler myocardial imaging and tranthoracic and transesophageal echocardiographic study. Circulation 2005;112:387-95.
30. Boyd A, Schiller NB, Ross D, Thomas L. Segmental atrial contraction in patients restored to sinus rhythm after cardioversion for chronic atrial fibrillation: a colour Doppler tissue imaging study. Eur J Echocardiogr 2008;9:12-17.
31. Kaya E, Tokgozoglu L, Aytemir K, Kocabas U, Tulument E, Deveci O et al. Atrial myocardial deformation properties are temporarily reduced after cardioversion for atrial fibrillation and correlate well with atrial appendage function. Eur J Echocardiogr 2008;9:472-7.
32. Reynen K. Cardiac myxomas. N Engl J Med 1995;333:1610 -7.
33. Gowda RM, Khan IA, Nair CK, Mehta NJ, Vasavada BC, Sacchi TJ. Cardiac papillary fibroelastoma: a comprehensive analysis of 725 cases. Am Heart J 2003;146:404 -10.
34. Salem DN, Stein PD, Al-Ahmad A, et al. Antithrombotic therapy in valvular heart disease-native and prosthetic. Chest 2004;126:457S- 82S.
35. Roudaut R, Serri K, Lafitte S. Thrombosis of prosthetic heart valves: diagnosis and therapeutic considerations. Heart 2007;93:137-42.
36. Tong AT, Roudaut R, Ozkan M, et al. Transesophageal echocardiography improves risk assessment of thrombolysis of prosthetic valve thrombosis: results of the international PRO-TEE registry. J Am Coll Cardiol 2004;43:77-84.
37. Mylonakis E, Calderwood SB. Infective endocarditis in adults. N Engl J Med 2001;345:1318 -30.
38. Cabell CH, Pond KK, Peterson GE, et al. The risk of stroke and death in patients with aortic and mitral valve endocarditis. Am Heart J 2001;142:75- 80.
39. Di Salvo G, Habib G, Pergola V, et al. Echocardiography predicts embolic events in infective endocarditis. J Am Coll Cardiol 2001;37: 1069-76.
40. Reisner SA, Brenner B, Haim N, Edoute Y, Markiewicz W. Echocardiography in nonbacterial thrombotic endocarditis: from autopsy to clinical entity. J Am Soc Echocardiogr 2000;13: 876-81.
41. Dutta T, Karas MG, Segal AZ, Kizer JR. Yield of Transesophageal echocardiography for nonbacterial thrombotic endocarditis and other cardiac sources of embolism in cancer patients with cerebral ischemia. Am J Cardiol 2006;97:894-8.
42. Kizer JR, Devereux RB. Patent foramen ovale in young adults with unexplained stroke. N Engl J Med 2005;353:2361-72.
43. Overell JR, Bone I, Less KR. Interatrial septal abnormalities and stroke. A meta-analysis of case-control studies. Neurology 2000;55: 1172-9.
44. Lechat P, Mas JL, Lascault G et al. Prevalence of patent foramen ovale in patients with stroke. N Engl J Med 1988;318:1148-52.
45. Webster MWI, Chancellor AM, Smith HJ et al. Patent foramen ovale in young stroke patients. Lancet 1988;2:11-2.
46. Kerut EK, Norfleet WT, Plotnick GD et al. Patent foramen ovale: a review of associated conditions and the impact of physiological size. J Am Coll Cardiol 2001;38:613-23.
47. Meissner I, Khandheria BK, Heit JA, et al. Patent foramen ovale: innocent or guilty? Evidence from a prospective population-based study. J Am Coll Cardiol 2006;47:440 -5.
48. Di Tullio MR, Sacco RL, Sciacca RR, et al. Patent foramen ovale and the risk of ischemic stroke in a multiethnic population. J Am Coll Cardiol 2007;49:797- 802.
49. Meacham RR, Headley AS, Bronze MS, et al. Impending paradoxical embolism. Arch Intern Med 1998;158: 438-48.
50. Agmon Y, Khanderia BK, Meissner I, et al. Frequency of atrial septal aneurysms in patients with cerebral ischemic events. Circulation 1999;99:1942- 4.
51. Mugge A, Daniel W, Angermann C, et al. Atrial septal aneurysm in adult patients. A multicenter study using transthoracic and Transesophageal echocardiography. Circulation 1995;91:2785-92.
52. Berthet K, Lavergne T, Cohen A, et al. Significant association of atrial vulnerability with atrial septal abnormalities in young patients with ischemic stroke of unknown cause. Stroke 2000;31:398-403.
53. Barnett HJM, Boughner DR, Taylor DW, et al. Further evidence relating mitral-valve prolapse to cerebral ischemic events. N Engl J Med 1980;302:139-44.
54. Orencia AJ, Petty GW, Khandheria BK, et al. Risk of stroke with mitral valve prolapse in a population-based cohort study. Stroke 1995;26:7-13.
55. Gilon D, Buonanno FS, Joffe MM, et al. Lack of evidence of an sociation between mitral-valve prolapse and stroke in young patients. N Engl J Med 1999;341:8 -13.
56. Nishimura RA, McGoon MD. Perspectives in mitral valve prolapse. N Engl J Med 1999;341:48-50.
57. Cardiogenic brain embolism. The second report of the Cerebral Embolism Task Force. Arch Neurol 1989;46:727-43.
58. Bonow RO, Carabello BA, Kanu C, et al. 2008 Focused Update Incorporated Into the ACC/AHA 2006 Guidelines for the Management of Patients With Valvular Heart Disease: a report of the American College of Cardiology/American Heart ssociation Task Force on Practice Guidelines. J. Am. Coll. Cardiol. 2008;52;e1-e142
59. Karas MG, Francescone S, Segal AZ, et al. Relation between mitral annular calcium and complex aortic atheroma in patients with cerebral ischemia referred for transesophageal echocardiography. Am J Cardiol 2007;99:1306 -11.
60. Agmon Y, Khanderia BK, Meissner I, et al. Aortic valve sclerosis and aortic atherosclerosis: different manifestations of the same disease? J Am Coll Cardiol 2001;38:827-34.
61. Kizer JR, Wiebers DO, Whisnant JP, et al. Mitral annular calcification, aortic valve sclerosis, and incident stroke in adults free of clinical cardiovascular disease: the Strong Heart study. Stroke 2005;36: 2533-7.
62. Petty GW, Khanderia BK, Whisnant JP, et al. Predictors of cerebrovascular events and death among patients with valvular heart disease. A population-based study. Stroke 2000;31:2628 -35.
63. Voros S, Nanda NC, Thakur AC, et al. Lambl's excrescences (valvular strands). Echocardiography 1999;16:399-414.
64. Roldan CA, Shively BK, Crawford MH. Valve excrescences: prevalence, evolution and risk for cardioembolism. J Am Coll Cardiol 1997;30:1308 -14.
65. Cohen A, Tzourio C, Chauvel C, et al. Mitral valve strands and the risk of ischemic stroke in elderly patients. Stroke 1997;28:1574-8
66. Homma S, Di Tullio MR, Sciacca RR, et al. Effect of aspirin and warfarin therapy in stroke patients with valvular strands. Stroke 2004;35:1436-42.