|
Tumori e Malattia cardiovascolare nell’Anziano e nel grande Anziano.
Nicola Maurea, Giovanna Piscopo, Carmela Coppola, Clemente Cipresso, Carlo Maurea, Angelo Sabato Boccia. Struttura Complessa di Cardiologia, Istituto Nazionale Tumori, Fondazione Pascale, Napoli.
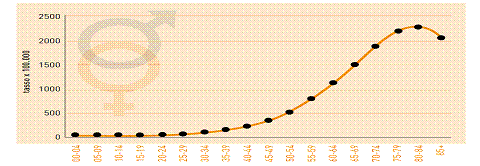
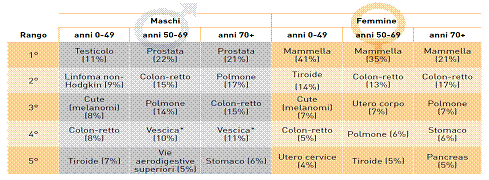
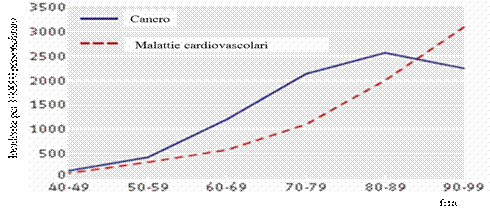
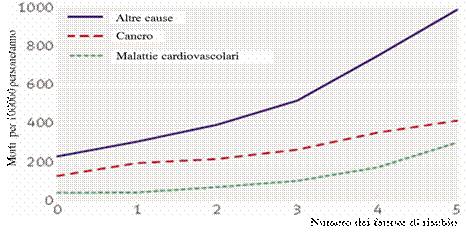
I tumori sono una malattia prevalentemente dell’età adulta-avanzata. Nella fig. 1sono evidenziati i tassi di incidenza per tutti i tumori, specifici per fasce quinquennalid’età. Si nota come nelle prime decadi della vita, la frequenza dei tumori sia dell’ordine, al massimo, di qualche decina di casi ogni 100.000 persone;dopo i 35 anni si supera il centinaio di casi, mentre dopo i 60 anni sicambia ancora ordine di grandezza superando il migliaio di casi ogni 100.000persone, ovvero raggiungendo una frequenza di 1-3 casi ogni 100 persone/anno. Nella classe d’età adulta (50-69 anni), sono diagnosticati quasi il 40% deltotale dei tumori e tra questi i più frequenti sono, tra gli uomini, il tumore dellaprostata (22%), del colon-retto (15%), del polmone (14%), della vescica (10%)e delle vie aerodigestive superiori (cavità orale, laringe e faringe, 5%). Tra le donne di età 50-69 anni, i tumori più frequenti sono quello della mammella(35%), seguito dal tumore del colon-retto (13%), del corpo dell’utero (7%), delpolmone (6%) e della tiroide (5%). È tra gli anziani con età > 70 anni che viene diagnosticato il maggior numero dineoplasie (pari al 50% circa del totale dei tumori). Tra gli uomini, la prostata è al primoposto (21%), seguita dal polmone (17%), dai tumori del colon-retto (15%), dellavescica (11%) e dello stomaco (6%); tra le donne è sempre la mammella il tumorepiù frequentemente diagnosticato (21%), seguito dal colon-retto (17%),dal polmone (7%), dallo stomaco (6%) e dal pancreas (5%) (tab. 1). Nella fig. 2 potete vedere l’incidenza delle malattie cardiovascolari e del cancro con l’aumentare dell’età, mentre nella fig. 3 è possibile osservare come cancro e malattie cardiovascolari condividano gli stessi fattori di rischio e la mortalità aumenti con l’incremento dei fattori di rischio.In oncologia, nel paziente anziano, l’età non è più un pregiudizio ai trattamenti farmacologici oncologici. In alcuni di questi tumori, la chemioterapia e le terapie biologiche, possono provocare problemi cardiovascolari in una percentuale anche più alta della eventuale recidiva di cancro. Le antracicline Le antracicline sono tra i farmaci più efficaci nel trattamento dei tumori solidi e delle neoplasie ematologiche, tuttavia provocano diversi effetti collaterali. Causano cardiotossicità a breve e a lungo termine, inclusa una disfunzione cardiaca congestizia potenzialmente fatale. Nei pazienti anziani in cui spesso concomitano ipertensione, diabete, sindrome metabolica e ridotta riserva coronarica, si riscontra maggiore sensibilità a questi problemi (tab. 2). Nella tab. 2 sono indicati i fattori di rischio correlati alla cardiotossicità da antracicline; come potete osservare l’età è uno dei più importanti. Figura 1. AIRTUM 2006-2008. Tassi d’età specifici (x 100.000). Tutti i tumori esclusi carcinomi della cute, maschi e femmine assieme
.Tabella 1. Primi cinque tumori in termini di frequenza e proporzione sul totale dei tumori incidenti (esclusi i carcinomi della cute) per sesso e fascia di età. Pool Airtum 2006-2008.* comprende sia tumori infiltranti che non infiltranti
. Figura 2. Incidenza delle neoplasie e delle malattie cardiovascolari con la progressione dell’età. Jane A Driver et Al. BMJ 2008
Figura 3. La mortalità aumenta sia per il cancro che per le malattie cardiovascolari al crescere dei fattori di rischio. Rob M. van Dam et Al. BMJ 2008
Tabella 2: Fattori di rischio per la cardiotossicità da antracicline. Singal et al, N Engl J Med. 1998
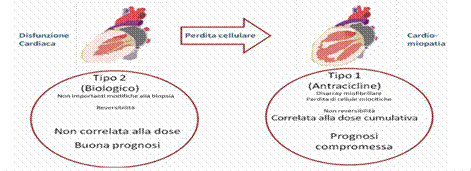
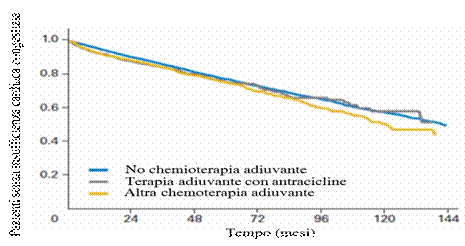
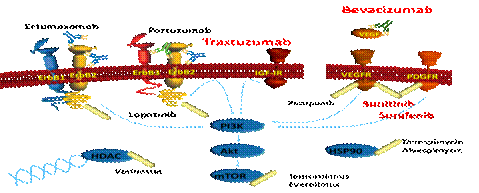
Fattori di rischio di sviluppo di disfunzione cardiaca da Antracicline Le antracicline causano una cardiopatia dilatativa di tipo I (fig. 4), le cui caratteristiche ultrastrutturali sono: disorganizzazione miofibrillare e perdita di miociti. Tale cardiopatia sembra essere dose correlata ed ha una prognosi compromessa.È stato dimostrato in donne di età compresa tra i 66 e i 70 anni, sottoposte a terapia in adiuvante per cancro della mammella, che il trattamento con antracicline, determinava una incidenza di scompenso cardiaco a 10 anni superiore rispetto a chi riceveva altro trattamento chemioterapico o rispetto a chi non faceva chemioterapia (fig. 5). La malattia arteriosa coronarica, la bronchite, il diabete, l’ipertensione, l’infarto miocardico e l’arteriopatia obliterante degli arti inferiori, in questa serie di pazienti, costituivano un fattore indipendente di rischio. Negli ultimi anni la target-therapy (terapia a bersaglio) ha rivoluzionato l’approccio al paziente oncologico con risultati eclatanti in termini di guarigione e allungamento della sopravvivenza. Nella pratica clinica però, questi farmaci hanno dimostrato una serie di effetti collaterali, dei quali i cardiovascolari possono essere i più pericolosi per la vita del paziente. I farmaci più utilizzati della target therapy sono gli inibitori di ErbB2 e gli inibitori dell’angiogenesi (fig. 6). Figura 4: Disfunzione cardiaca di tipo I (antracicline) e di tipo II (terapie biologiche)
Figura 5. Pazienti tra i 66 e 70 anni senza insufficienza cardiaca che ricevono chemioterapia adiuvante. Pinder, J Clin Oncol 2007
Figura 6
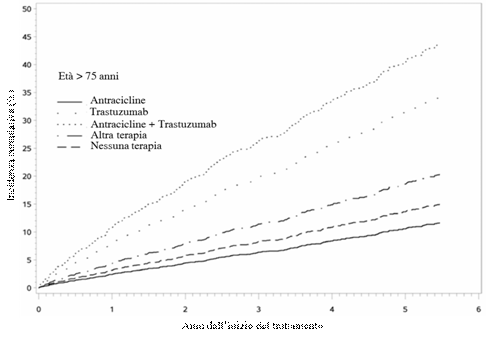
Inibitori di ErbB2 Il Trastuzumabne è il capostipite; altri farmaci sono il Pertuzumab e il Lapatinib. Il Trastuzumab è un anticorpo monoclonale agonista del recettore ErbB2, iperespresso nel 25% dei casi di cancro mammario e per questo utilizzato in ¼ delle pazienti affette da questa neoplasia. Fin dal 2005, è stato dimostrato che il Trastuzumab, usato singolarmente o in combinazione con la chemioterapia, riduce il rischio di recidiva del 50% e il rischio di morte del 33%. Purtroppo si è evidenziato nel tempo che la cardiotossicità costituisce un importante effetto collaterale. La cardiotossicità è in relazione al blocco di ErbB2 nei cardiomiociti e si manifesta come scompenso cardiaco o disfunzione ventricolare sinistra asintomatica.Studi clinici condotti sul Lapatinib, piccola molecola inibitore tirosin-chinasico di ErbB2, dimostrano che la safety cardiaca della terapia anti-ErbB2 è agente-specifica; infatti il Lapatinib determina minore cardiotossicità rispetto al Trastuzumab. Per il Pertuzumab, un nuovo anticorpo monoclonale, è stata segnalata la riduzione della frazione di eiezione in percentuali simili a quelle riscontrate con Trastuzumab. I meccanismi della cardiotossicità da Trastuzumab non sono completamente noti e comunque sono differenti da quelli delle antracicline: in particolare il Trastuzumab non sembra causare perdita di miociti. In pazienti con disfunzione cardiaca da Trastuzumab, i miociti appaiono istologicamente normali; delle alterazioni possono essere visualizzate soltanto utilizzando la microscopia elettronica, in accordo con la frequente reversibilità della cardiomiopatia. Tale cardiomiopatia è definita di tipo II, per differenziarla dal tipo I delle antracicline (fig. 4) edè caratterizzata da parziale reversibilità, non è correlata alla dose, non presenta importanti alterazioni istologiche alla biopsia miocardica e, ha una buona prognosi a differenza della cardiomiopatia correlata alle antracicline. Uno dei fattori di rischio per tossicità più importante è l’età (vedi tab. 3). Abbiamo recentemente creato un network, l’Italian Cardio-Oncological Network, e abbiamo analizzato 500 pazienti affette da neoplasia mammaria in trattamento con Trastuzumab. Abbiamo verificato in soggetti con età superiore ai 60 anni una tossicità più alta che raggiungeva il 38% nelle donne con età superiore ai 68 anni. Queste pazienti erano quelle che avevano una maggiore incidenza di ipertensione, diabete, dislipidemia, aumentato rischio cardiovascolare globale, abitudine al fumo, storia di malattia coronarica. Questi nostri dati sono stati confermati da un recente studio retrospettivo su 12500 pazienti negli Stati Uniti, in cui la tossicità da Trastuzumab sembra crescere nel corso dei 5 anni dall’inizio del trattamento in maniera progressiva e può raggiungere anche il 45% nei pazienti superiori ai 75 anni (fig. 7). Le conclusioni di questo lavoro sono state poi ulteriormente validate da un altro studio retrospettivo su database amministrativi della SEER-Medicare Cohort su 45537 pazienti anziane (età media 76,2 anni), in cui ritroviamo una incidenza progressiva di cardiotossicità ad uno, due e tre anni rispettivamente del 15, 20, 26% in caso di terapia con il solo Trastuzumab e del 16, 23 e 28% in caso di associazione tra antracicline e Trastuzumab.
Fattori di rischio di sviluppo di disfunzione cardiaca da Trastuzumab
Tabella 3: Fattori di rischio per la cardiotossicità da Trastuzumab. Suter et al, Breast. 2004
Figura 7 . Bowles, JNCI 2012
Inibitori dell’angiogenesi Interferire con l’angiogenesi tramite l’inibizione del vascular endothelial growth factor (VEGF) è un approccio efficace e largamente diffuso nella terapia del cancro; purtroppo le terapie antiangiogeniche possono provocare importanti effetti cardiovascolari sistemici come l’ipertensione, la disfunzione ventricolare sinistra, l’insufficienza cardiaca, la cardiopatia ischemica, l’infarto del miocardio e l’allungamento del tratto QT. Gli inibitori del signaling del VEGF attualmente in commercio in Italia sono: Bevacizumab, Sunitinib, Sorafenib, Pazopanib e Vandetanib. Poiché l’uso di questi farmaci è in crescita e vengono sempre più utilizzati anche in pazienti anziani, gli effetti collaterali sono sempre più frequenti e i cardiologi dovranno sempre di più interagire con l’oncologo per curare pazienti che sviluppano problematiche cardiovascolari. Il Bevacizumab è un anticorpo monoclonale che agisce sul VEGF circolante, con indicazionenel trattamento del carcinoma metastatico del colon-retto, del polmone, della mammella e del rene. L’effetto cardiotossico più frequente è l’ipertensione arteriosa, con una incidenza variabile dal 4% al 35% dei casi; l’ipertensione arteriosa di grado 3 nell’ 11%-18% dei casi.Nella patogenesi dell’ipertensione arteriosa assume un ruolo molto importante l’inibizione dell’ossido nitrico sintetasi, che determina una riduzione dell’ossido nitrico endoteliale, con conseguente vasocostrizione ed aumento pressorio. Raro lo scompenso cardiaco riportato solo nell’1,6% dei casi. Il Sunitinib e il Sorafenib sono piccole molecole, inibitori multi-target delle tirosino chinasi, ad attività antiangiogenica che agiscono sui recettori intracellulari del VEGF. Sono utilizzati, il primo nel carcinoma metastatico del rene e nei GIST (tumori stromali gastrointestinali), il secondo nel carcinoma metastatico renale e nell’epatocarcinoma. Con il Sunitinib è stata riportata ipertensione arteriosa sia nei trials clinici (5%-24%; di grado 3 nel 2%-8%) sia in una analisi retrospettiva(nel 47% dei casi; di grado 3 nel 17%). Nella stessa analisiè stata riportata una incidenza di scompenso cardiaco di classe NYHA III-IV, nell’8% dei casi. Il Sorafenib causa ipertensione arteriosa in percentuali simili a quella del Sunitib, ma con una incidenza di insufficienza cardiaca sicuramente inferiore. Come gestire gli eventi avversi degli inibitori dell’angiogenesi? Riteniamo che in futuro avremo meno eventi cardiovascolari nel corso di queste terapie perché l’oncologo ha scoperto la pre-ipertensione. Soltanto a partire dal Maggio del 2009 il primo criterio di tossicità ipertensiva utilizzato nei trials in oncologia (National Cancer Institute) è la pre-ipertensione (120/80mmHg– 139/89mmHg); fino ad allora si considerava evento tossico di primo grado una pressione arteriosa che doveva superare i 150/100 mmHg. Vi sono evidenze in letteratura (fig.8) che l’apoptosi dei cardiomiociti si verifica nel topo da esperimento sottoposto a terapia anti-VEGF solo se è presente ipertensione arteriosa. Questo dato sperimentale traslato alla clinica impone durante la pratica quotidiana la riduzione aggressiva della pressione arteriosa al fine di ottenere la diminuzione dell’incidenza di insufficienza cardiacain questi pazienti. Per tali motivi consigliamo di seguire l’algoritmo della fig. 9 in cui ad esempio è evidente che la pre-ipertensione, se associata anche ad un solo fattore di rischio, va trattata farmacologicamente prima di iniziare il trattamento oncologicoE’ necessario, inoltre, trattare aggressivamente i fattori di rischio elencati nella tab. 4, ed è opportuna un’accurata raccolta anamnestica volta, tra l’altro, ad identificare, nelle donne che hanno avuto una gravidanza, la comparsa di “HELLP Syndrome” che è una particolare forma di preeclampsia che sembra legata ad una disregolazione del signaling del VEGF. È intuitivo pensare che una popolazione con più fattori di rischio cardiovascolare come quella anziana possa essere più soggetta ad eventi cardiovascolari correlati con questi farmaci.
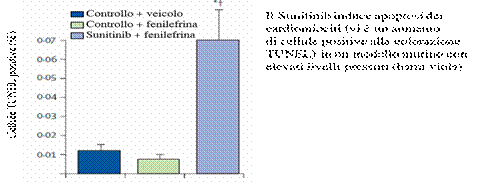
Figura 8: Induzione di apoptosi indotta dal Sunitinib nell’ambito dell’ipertensione. Chu, Lancet 2007
.
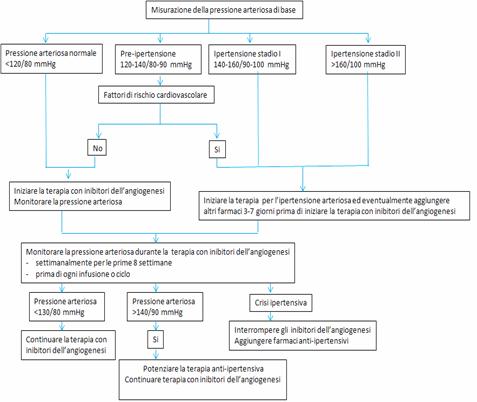
Figura 9: Management dell’ipertensione indotta da farmaci inibitori dell’angiogenesi. Ederhy, Clin Rev Oncol Hematol 2011
Tabella 4: Fattori di rischio per eventi cardiaci in corso di terapia con inibitori di VEGF
Oltre all’ipertensione e alla disfunzione sistolica ventricolare sinistra, questi farmaci possono provocare o slatentizzare una cardiopatia ischemica per cui, dopo un’accurata selezione del paziente da trattare con inibitori del VEGF, consigliamo di seguire le indicazioni della tab. 5 È evidente quindi come questi farmaci possano provocare maggiore tossicità nei pazienti anziani.
Tabella 5: Raccomandazioni per gestire l’ischemia cardiaca associata alla terapia con inibitori del VEGF
In definitiva si rende sempre più necessaria una gestione integrata e collaborativa tra il cardiologo e l’oncologo che deve includere: - la gestione precoce ed aggressiva dei fattori di rischio; - il trattamento dell’ipertensione nei pazienti trattati con inibitori di VEGF; - la stretta vigilanza dei sintomi associati a disfunzione cardiaca con monitoraggio della frazione di eiezione del ventricolo sinistro e possibile monitoraggio dei biomarcatori cardiaci nei pazienti a più elevato rischio. Un approccio di questo tipo che consente di trattare adeguatamente la gestione della tossicità cardiovascolare nei pazienti oncologici sarà ancora più utile nell’anziano. Questa fase della vita proprio per la maggiore presenza di fattori di rischio e comorbidità, rende questi pazienti più suscettibili a farmaci che, parlo specialmente per i biologici, hanno prodotto risultati straordinari nella cura del tumore, ma inaspettatamente hanno provocato una serie di problematiche cardiovascolari nuove e tutte da esplorare.
Bibliografia 1. AIOM-AIRTUM: i numeri del cancro in Italia 2012. www.aiom.it 2. Maurea N, Coppola C, Ragone G, Frasci G, Bonelli A, Romano C, Iaffaioli RV. Women survive breast cancer but fall victim to heart failure: the shadows and lights of targeted therapy.J Cardiovasc Med (Hagerstown). 2010 Dec;11(12):861-8 3. Tocchetti CG, Ragone G, Coppola C, Rea D, Piscopo G, Scala S, De Lorenzo C, Iaffaioli RV, Arra C, Maurea N. Detection, monitoring, and management of trastuzumab-induced left ventricular dysfunction: an actual challenge.Eur J Heart Fail. 2012 Feb;14(2):130-7 4. Tocchetti CG, Coppola C, Arra C, Maurea N. Early identification of left ventricular dysfunction induced by trastuzumab. J Am Coll Cardiol. 2011;58(25):2698-9 5. Fedele F, Riccio G, Coppola C, Barbieri A, Monti MG, Arra C, Tocchetti CG,D’Alessio G, Maurea N, De Lorenzo C. Comparison of cardiotoxic effects of different ErbB2 inhibitors. Breast Cancer Res Treat 2012; 133(2):511-521 6. Tarantini L, Cioffi G, Gori S, Tuccia F, Boccardi L, Bovelli D, Lestuzzi C, Maurea N, Oliva S, Russo G, Faggiano P; Italian Cardio-Oncologic Network. Trastuzumab adjuvant chemotherapy and cardiotoxicity in real-world women with breast cancer. J Card Fail. 2012 Feb;18(2):113-9 7. Oliva S, Cioffi G, Frattini S, Simoncini EL, Faggiano P, Boccardi L, Pulignano G, Fioretti AM, Giotta F, Lestuzzi C, Maurea N, Sabatini S, Tarantini L; Italian Cardio-Oncological Network. Administration of angiotensin-converting enzyme inhibitors and β-blockers during adjuvant trastuzumab chemotherapy for nonmetastatic breast cancer: marker of risk or cardioprotection in the real world? Oncologist. 2012;17(7):917-24 8. Tocchetti CG, Gallucci G, Coppola C, Piscopo G, Cipresso C, Maurea C, Giudice A, Iaffaioli RV, Arra C, Maurea N. The emerging issue of cardiac dysfunction induced by antineoplastic angiogenesis inhibitors.Eur J Heart Fail. 2013 May;15(5):482-9 9. Bowles EJ, Wellman R, Feigelson HS, Onitilo AA, Freedman AN, Delate T, Allen LA, Nekhlyudov L, Goddard KA, Davis RL, Habel LA, Yood MU, McCarty C, Magid DJ, Wagner EH; Pharmacovigilance Study Team. Risk of heart failure in breast cancer patients after anthracycline and trastuzumab treatment: a retrospective cohort study.J Natl Cancer Inst.2012 Sep 5;104(17):1293-30 10. Chen J, Long JB, Hurria A, Owusu C, Steingart RM, Gross CP. Incidence of heart failure or cardiomyopathy after adjuvant trastuzumab therapy for breast cancer.J Am Coll Cardiol. 2012 Dec 18;60(24):2504-12 11. Driver JA, Djoussé L, Logroscino G, Gaziano JM, Kurth T.Incidence of cardiovascular disease and cancer in advanced age: prospective cohort study.BMJ. 2008 Dec 9;337:a2467 12. van Dam RM, Li T, Spiegelman D, Franco OH, Hu FB. Combined impact of lifestyle factors on mortality: prospective cohort study in US women.BMJ. 2008 Sep 16;337:a1440 13. Capasso I, Esposito E, Pentimalli F, Montella M, Crispo A, Maurea N, D'Aiuto M, Fucito A, Grimaldi M, Cavalcanti E, Esposito G, Brillante G, Lodato S, Pedicini T,D'Aiuto G, Ciliberto G, Giordano A. Homeostasis model assessment to detect insulin resistance and identify patients at high risk of breast cancer development: National Cancer Institute of Naples experience. J Exp Clin Cancer Res. 2013 Mar 14;32:14 14. Capasso I, Esposito E, Maurea N, Montella M, Crispo A, De Laurentiis M, D'Aiuto M, Frasci G, Botti G, Grimaldi M, Cavalcanti E, Esposito G, Fucito A, Brillante G, D'Aiuto G, Ciliberto G. Combination of inositol and alpha lipoic acid in metabolic syndrome-affected women: a randomized placebo-controlled trial.Trials. 2013 Aug 28;14(1):273 15. Singal PK, Iliskovic N.Doxorubicin-induced cardiomyopathy. N Engl J Med.1998 Sep 24;339(13):900-5 16. Pinder MC, Duan Z, Goodwin JS, Hortobagyi GN, Giordano SH.Congestive heart failure in older women treated with adjuvant anthracycline chemotherapy for breast cancer. J Clin Oncol. 2007 Sep 1;25(25):3808-15 17. Suter TM, Cook-Bruns N, Barton C. Cardiotoxicity associated with trastuzumab (Herceptin) therapy in the treatment of metastatic breast cancer. Breast.2004 Jun;13(3):173-83 18. Bowles EJ, Wellman R, Feigelson HS, Onitilo AA, Freedman AN, Delate T, Allen LA, Nekhlyudov L, Goddard KA, Davis RL, Habel LA, Yood MU, McCarty C, Magid DJ, Wagner EH; Pharmacovigilance Study Team. Risk of heart failure in breast cancer patients after anthracycline and trastuzumab treatment: a retrospective cohort study.J Natl Cancer Inst. 2012 Sep 5;104(17):1293-305 19. Chu TF, Rupnick MA, Kerkela R, Dallabrida SM, Zurakowski D, Nguyen L, Woulfe K, Pravda E, Cassiola F, Desai J, George S, Morgan JA, Harris DM, Ismail NS, Chen JH, Schoen FJ, Van den Abbeele AD, Demetri GD, Force T, Chen MH. Cardiotoxicity associated with tyrosine kinase inhibitor sunitinib.Lancet. 2007 Dec 15;370(9604):2011-9 20. Ederhy S, Izzedine H, Massard C, Dufaitre G, Spano JP, Milano G, Meuleman C, Besse B, Boccara F, Kahyat D, Cohen A, Soria JC. Cardiac side effects of molecular targeted therapies: towards a better dialogue between oncologists and cardiologists.Crit Rev Oncol Hematol. 2011 Dec;80(3):369-79
|