L’ oggi e domani della cardiochirurgia
Antonio Panza, Antonio Longobardi, Emanuele De Ruberto,
Antonella Villano, Mario Miele, Giuseppe Di Benedetto
Struttura Complessa di Cardiochirurgia, Dipartimento “Cuore”, Azienda Ospedaliera Universitaria San Giovanni di Dio e Ruggi d’Aragona, Salerno
Nel corso degli anni, le procedure cardiochirurgiche, ideate negli anni cinquanta dello scorso secolo, sono state perfezionate e continuano ogni giorno a progredire, facendo si che i risultati della chirurgia siano sempre migliori, anche a fronte di una popolazione di pazienti sempre più anziani e affetti da forme patologiche sempre più gravi e complesse.
A questo proposito, non devono essere sottovalutati gli importanti progressi che si sono realizzati in campo della anestesia e della terapia intensiva, caratterizzati dalla utilizzazione di sempre più precise metodiche di monitoraggio delle funzioni vitali dei pazienti e dall’impiego di efficaci farmaci di nuova generazione, che hanno profondamente modificato la gestione dei pazienti e hanno consentito di migliorare considerevolmente i risultati clinici.
I campi in cui si sono registrati i cambiamenti più significativi sono la chirurgia coronarica e la chirurgia valvolare aortica
CARDIOPATIA ISCHEMICA E CARDIOCHIRURGIA
Il progresso della chirurgia coronarica
Nelle tre decadi iniziali della chirurgia coronarica numerose innovazioni e scoperte nel campo della tecnica chirurgica e dello studio della malattia aterosclerotica coronarica (MACO) hanno mutato i protocolli della rivascolarizzazione miocardica (BPAC: bypass aorto-coronarico). In ogni decade, il trattamento convenzionale è stato rivisitato e spesso modificato radicalmente.
I progressi della chirurgia coronarica si basano sulla acquisizione di nuove tecnologie, tecniche interventistiche e conoscenze patofisiologiche che hanno permesso di creare protocolli chirurgici validati da ampi studi retrospettivi o randomizzati prospettici.
Le recenti linee guida congiunte ed edite dalla Società Europea di Cardiologia (ESC) e dall’ Associazione Europea di Chirurgia Cardiotoracica (EACTS) sono espressione di importanti cambiamenti che hanno trasformato le opzioni terapeutiche della MACO. In particolare i progressi della rivascolarizzazione percutanea e chirurgica hanno imposto una profonda revisione delle indicazioni invasive in rapporto alle diverse espressioni della patologia ischemica cardiaca.
Heart Team
Le linee guida prevedono, fatta eccezione per le urgenze, la costituzione di un Heart Team di cui fanno parte il cardiologo, l'emodinamista e il cardiochirurgo, i quali valutino, insieme al paziente, i vantaggi di una scelta terapeutica rispetto alle altre, identificando così il percorso migliore. Pertanto il paziente è posto al centro del processo decisionale e la soluzione terapeutica viene ritagliata sul quadro anatomico-clinico del soggetto in esame. L’ Heart Team è il vero gestore della strategia terapeutica, sottraendola all’arbitrio del singolo cardiologo clinico, cardiologo interventista e cardiochirurgo.
Le linee guida ESC/EACTS sottolineano come la migliore strategia di rivascolarizzazione dipenda dal contesto culturale e sociale, con una necessaria ed obbligatoria interazione tra cardiologi, cardiochirurghi e medici di medicina generale. In particolare, le linee guida introducono in modo chiaro il concetto, ribadendolo più volte, della collaborazione interdisciplinare tra cardiologo interventista, cardiochirurgo e cardiologo clinico (Heart Team).
PCI differita
Le linee guida ESC/EACTS sulla rivascolarizzazione miocardica consigliano la PCI effettuata nella stessa seduta dell’angiografia coronarica diagnostica, chiamata PCI ad hoc, in alcune circostanze quali l’instabilità emodinamica (incluso lo shock cardiogeno), la lesione colpevole (culprit lesion) nell’infarto miocardico con (STEMI) o senza sopraslivellamento del tratto ST (NSTEMI), e la malattia stabile di uno o due vasi con esclusione dei pazienti con malattia dell’arteria discendente anteriore (LAD) prossimale. In altri casi, come le lesioni ad alto rischio, insufficienza renale (se il volume di contrasto richiesto è >4 ml/kg), malattia multivasale, che coinvolge la LAD, pazienti stabili con lesione complessa o ostiale della LAD, o evidenza clinica o angiografica di un alto rischio procedurale con PCI, la procedura dovrebbe essere differita. Pertanto, il trattamento percutaneo deve essere differito rispetto alla coronarografia nei seguenti casi:
• Lesioni con morfologia ad alto rischio
• Pazienti “stabili” e multivasali
• Pazienti “stabili” e con lesione complessa ostiale dell’IVA
Indicazione alla rivascolarizzazione “meccanica” (PCI o BPAC)
Syntax score
La comparsa dello studio SYNTAX (acronimo che significa SYNergy fra TAXus e cardiac surgery) ha rappresentato un punto di svolta nella diagnosi, stratificazione del rischio ed indirizzo terapeutico a breve e lungo termine della MACO. Tale trial comparava i risultati della rivascolarizzazione chirurgica e percutanea in pazienti con lesioni coronariche multivasali associate o meno ad una lesione del tronco comune. La peculiarità di tale studio era rappresentata dalla possibilità di definire la complessità anatomica delle lesioni da trattare. La severità e l’estensione delle lesioni coronariche erano definite ricorrendo ad una nuova classificazione: il SYNTAX score. Tale punteggio si basa su nove criteri anatomici, incluso numero, complessità e posizione della lesione. Punteggi SYNTAX più alti indicano pazienti con patologia più complessa e maggiori difficoltà di trattamento percutaneo. Con questo approccio metodologico si superano le incongruenze di comparazione che erano alla base di numerosi studi che valutavano l’efficacia della PCI versus il BPAC.
Indicazioni lesioni mono-multivasali
La rivascolarizzazione meccanica è indicata nelle mono o bivasali con coinvolgimento dell’interventricolare anteriore prossimale (IVA) ed in tutti i trivasali. La superiorità del BPAC è sempre presente, anche se l’opzione PCI è una valida alternativa nei mono o bivasali e nei trivasali con lesioni coronariche non complesse (SYNTAX score ≤ 22).
Lesione BPAC PCI
Monovasale o bivasale + IVA prossimale I A IIaB
Trivasale + SYNTAX score ≤ 22 I A IIaB
Trivasale + SYNTAX score > 22 I A IIIA
Indicazioni lesioni del tronco comune (TC)
I pazienti con lesione isolata dell’ostio o del corpo del tronco comune, anche se multivasali ma con lesioni non complesse (Syntax score < 32) possono essere considerati candidati alla PCI, anche se il BPAC è superiore. L’opzione percutanea prende forza in presenza di comorbidità, che elevino il rischio previsto in caso di intervento chirurgico (Euroscore > 5).
Lesione BPAC PCI
TC ostio o corpo isolato o +1 vaso I A IIa B
TC biforcazione isolato o +1 vaso I A IIb B
TC + 2 vasi o 3 vasi + SYNTAX score ≤ 32 I A IIb B
TC + 2 vasi o 3 vasi + SYNTAX score >32 I A III A
Sindromi coronariche acute senza sopraslivellamento del tratto ST (SCA – NSTEMI)
La valutazione invasiva è da attuarsi < 2 ore nei pazienti ad altissimo rischio ischemico (angina refrattaria, instabilità emodinamica ed aritmia) e < 72 in quelli giudicati ad alto rischio. Se il paziente è instabile la PCI è la modalità di rivascolarizzazione meccanica da preferirsi. Invece nei pazienti stabile la valutazione sarà influenzata dall’Euroscore (rischio chirurgico) e dal Syntax score (rischio percutaneo). Comunque, spesso anche il paziente stabile è considerato complesso per l’opzione chirurgica sia per la recente acuzie che per i trattamenti antitrombotici ed antipiastrinici ai quali è sottoposto e, pertanto, ha spesso una corsia preferenziale verso la PCI.
Sindromi coronariche acute con sopraslivellamento del tratto ST (STEMI)
Il trattamento dello STEMI vede nella PCI primaria il gold standard, se è attuabile < 2 ore. Il BPAC in emergenza (ovvero da effettuarsi al posto della PCI primaria) è una evenienza rara e da effettuare solo nei seguenti casi:
1. Angina refrattaria alla terapia farmacologica o PCI
2. Progressiva insufficienza ventricolare
3. Presenza di una larga area di miocardio a rischio ischemico-necrotico ma entro 3-4 ore dallo STEMI (prima che la necrosi possa consolidarsi)
Altrimenti il BPAC ha una indicazione in urgenza. Ovvero nei pazienti con STEMI, che non possano o abbiano avuto una PCI primaria (localizzata alla sola culpit lesion), e che abbiano necessità di rivascolarizzazione chirurgica (vedi indicazione mono, mutivasali e TC) sono operati preferibilmente a distanza di 3 giorni dall’evento infartuale. Tale dilazione è praticabile se il paziente resta in quiescenza ischemica. Per i pazienti con lesioni anatomicamente ipercritiche è preferibile attuare il protocollo dell’attesa armata, che consiste in:
• Terapia farmacologica massimale
• Infusione di AGGRASTAT® (da sospendere 3 ore prima dell’intervento) + eparina ev (PTT 60-70”)
Shock cariogeno post-STEMI
Lo shock cardiogeno è la causa più frequente di morte ospedaliera nei pazienti con infarto miocardico acuto. Il miglior trattamento in questi pazienti è la riperfusione precoce e il supporto emodinamico per prevenire lo scompenso terminale e la morte. In questi pazienti non vi è un limite temporale tra l’inizio dei sintomi e l’angiografia coronarica e l’eventuale rivascolarizzazione. Le linee guida ESC/EACTS raccomandano la rivascolarizzazione di tutte le stenosi critiche epicardiche, non solo quella responsabile dell’infarto. La necessità di ricorrere ad un supporto meccanico è da prendersi sempre in considerazione se lo shock persiste a discapito di una rivascolarizzazione efficace ed alla contro pulsazione aortica. Il tipo di assistenza raccomandata dalle attuali linee guida è l’ECMO (acronimo per ExtraCorporeal Membrane Oxygenation). Tale pompa, impiantabile dal team cardochirurgico anche in emodinamica, ha un posizionamento percutaneo. La sua durata di assistenza è garantita < 30 giorni. Se lo svezzamento dall’ECMO è impossibile, dopo una valutazione dell’integrità neurologica ed in presenza di condizioni clinico-sociali favorevoli, si passa all’impianto di una assistenza ventricolare sinistra prolungata come soluzione definitiva o come bridge al trapianto cardiaco.
Note di tecnica chirurgica
Le raccomandazioni riguardanti la strategia chirurgica da adottare (linee guida ESC/EACTS) sono riassunte di seguito:
1. Rivascolarizzazione arteriosa estensiva (in ordine di preferenza):
a) arteria mammaria interna sinistra
b) arteria mammaria interna destra
c) arteria radiale sx (per stenosi > 80%)
d) vena safena
2. Utilizzo estensivo dei “composit grafts”
a) grafts multipli
b) no-touch aortic technique
3. Tecnica del cuore battente in tutti i casi
4. In assistenza CEC se instabilità emodinamica (assist do-not arrest technique)
5. Verifica intraoperatoria dei grafts mediante doppler
CHIRURGIA VALVOLARE AORTICA
La chirurgia valvolare aortica isolata, oggi, è gravata da un rischio operatorio estremamente ridotto. Secondo il registro dell’American Society of Thoracic Surgeons (STS), la chirurgia valvolare aortica
isolata ha una mortalità ospedaliera del 3-4% (che si riduceva a meno dell’1-2% nei centri con maggiore esperienza), ed un rischio di danno neurologico permanente dell’1.5-1.8%.
La corretta selezione del “candidato a chirurgia”, tuttavia, continua ad essere il momento critico sul quale
cardiologi e cardiochirurghi sono chiamati quotidianamente a confrontarsi, ed è quello da cui dipende il raggiungimento del difficile equilibrio tra la scelta terapeutica più adatta per il singolo paziente e l’attento, razionale utilizzo delle risorse disponibili.
La stenosi valvolare aortica è definita severa con i seguenti parametri ecocardiografici:
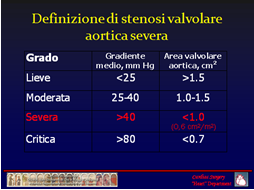
In tutti i pazienti con stenosi valvolare aortica sintomatici, l’indicazione chirurgica è certa. Nei pazienti asintomatici l’indicazione è certa nei seguenti casi:

Mentre è ragionevole nei seguenti casi:

La chirurgia della valvola aortica nell’anziano
Nel corso degli ultimi decenni l’aspettativa di vita della popolazione anziana è andata progressivamente aumentando in misura significativa sia negli uomini che nelle donne, tuttavia la qualità di vita di coloro che hanno raggiunto la cosiddetta “terza età” continua ad essere inficiata dalle numerose patologie e morbilità tipiche dell’età geriatrica. La valvulopatia aortica è una delle problematiche di più comune riscontro in età avanzata e costituisce una causa frequente di mortalità e morbilità. La drammaticità della storia naturale della patologia aortica sintomatica associata ai progressi compiuti nel trattamento chirurgico della stessa, spiegano il numero crescente di pazienti ultrasettantenni che viene oggi riferito per eventuale intervento di sostituzione valvolare aortica. Numerosi studi riportano una mortalità
per interventi di sostituzione valvolare aortica nella terza età compresa tra il 2 ed il 10%, una sopravvivenza attuariale a 5 anni del 70-80% ed un importante miglioramento sintomatologico e della qualità di vita in oltre il 90% dei pazienti
sopravvissuti all’intervento. Indubbiamente il rischio chirurgico risulta essere, entro certi limiti, proporzionale all’età del paziente. Secondo quanto riportato dall’STS Database, la mortalità ospedaliera dopo sostituzione valvolare aortica isolata è pari al 3.2% per età > 69 anni, al 5.3% tra i 70 e 79 anni ed all’8.5% tra gli 80 ed 89 anni. Nel porre indicazione ad intervento di sostituzione valvolare aortica nella terza età, il rapporto rischio-beneficio deve essere valutato con estrema accuratezza. Le condizioni generali del paziente, la presenza e severità di eventuali co-patologie ed il grado di “riserva d’organo residua” dovrebbero essere oggetto di particolare attenzione nel corso del delicato processo di “decision-making”. A tal proposito, dal momento che la riserva d’organo negli anziani è spesso prossima ai suoi limiti funzionali, ogni atto chirurgico che non sia strettamente necessario e che potrebbe soltanto aumentare il rischio di complicanze postoperatorie, dovrebbe essere consapevolmente omesso.
La chirurgia valvolare aortica può essere eseguita nella terza età con un rischio perioperatorio accettabile, una soddisfacente sopravvivenza a lungo termine ed un significativo miglioramento in termini di sintomatologia e capacità funzionale. Le maggiori risorse economiche, spesso necessarie per il trattamento chirurgico dei pazienti in età avanzata, potrebbero in larga misura essere recuperate dalla ridotta incidenza di ospedalizzazioni che fanno seguito all’intervento.
TAVI
La possibilità di impiantare una valvola aortica per via transcatetere è divenuta un’opzione utile nell’armamentario chirurgico. Nei pazienti con elevata mortalità per importanti patologie associate la TAVI ha offerto risultati incoraggianti. Nello studio PARTNER coorte A l’approccio transcatetere (percutaneo: 244 pz; transapicale: 104 pz) è stato confrontato con quello chirurgico convenzionale in pazienti ad alto rischio chirurgico ma considerato ancora accettabile (STS risk score > 15%). La TAVI è risultata essere non inferiore alla terapia chirurgica per mortalità ad 1 anno per tutte le cause. La mortalità ad 1 mese ed ad 1 anno è risultata statisticamente simile.
End point TAVI Chirurgia
Mortalità a 30 gg 3.4% 6.5%
Mortalità ad 1 anno 24.2% 26.8%
Fra le complicanze, l’ictus e le lesioni vascolari sono risultate superiori nel gruppo TAVI, mentre il sanguinamento è stato superiore nel gruppo chirurgico.
End point TAVI Surgery p
Sanguinamento 9.3% 19.5% <0.001
Complicanze vascolari 16% 8.6% <0.001
Ictus o TIA a 30 gg 5.5% 2.4% 0.04
Ictus o TIA ad 1 anno 8.3% 4.3% 0.04
Tali risultati confermano l’efficacia della TAVI quale opzione terapeutica nei pazienti affetti da SVA severa e con rischio chirurgico proibitivo. Tuttavia ad un anno circa un terzo dei pazienti sottoposti a TAVI è deceduto, e tale dato si offre a valutazioni controverse circa l’appropriatezza di utilizzare una procedura costosa quale la TAVI in tutti i pazienti. Inoltre l’ictus e i leaks paravalvolari rappresentano complicanze che possono sensibilmente peggiorare i risultati a distanza quod valetudinem.
Infine, le protesi impiantate per via percutanea dovranno dimostrare la loro durability. Infatti, non si deve correre il rischio di barattare un risultato immediato favorevole, senza badare al fatto che la protesi impiantata mediante un catetere abbia caratteristiche strutturali inferiori rispetto a quelle delle attuali protesi biologiche convenzionali utilizzate.