L’omeostasi del colesterolo tra fegato ed intestino
Alberto Corsini
Dipartimento di Scienze Farmacologiche e Biomolecolari ,
Università degli Studi di Milano
Considerazioni fisio-patologiche
Numerose evidenze epidemiologiche documentano come elevati livelli plasmatici di colesterolo, in particolare colesterolo LDL, siano associati ad un aumentato rischio di insorgenza di patologie cardiovascolari (1). Ne consegue che la conoscenze sui meccanismi fisio-patologici alla base dell’omeostasi del colesterolo nell’organismo sono fondamentali per poter controllare l’ipercolesterolemia in modo mirato ed altamente significativo. E’ noto che due sono le principali fonti del colesterolo plasmatico: la sintesi epatica e l’assorbimento intestinale di colesterolo (Fig.1). (1,2) Il contenuto totale di colesterolo in una persona adulta del peso di circa 70 kg è di 140 g ma solo lo 1% (1200 mg) va incontro a un ricambio giornaliero. Ogni giorno noi assumiamo dalla dieta circa 300-500 mg di colesterolo e 100g di trigliceridi. Questi lipidi si assemblano con circa 900 mg di colesterolo biliare e con gli acidi biliari al fine di formare delle micelle che permettono l’assorbimento di questo colesterolo di origine intestinale. Circa il 50% di tutto il colesterolo che è presente nell’intestino tenute viene assorbito dalla mucosa intestinale, il rimanente viene perso nelle feci (2). Una quota analoga di colesterolo viene sintetizzata a livello epatico ad evidenziare un contributo equipollente delle due vie nel fornire quotidianamente l’organismo di colesterolo.
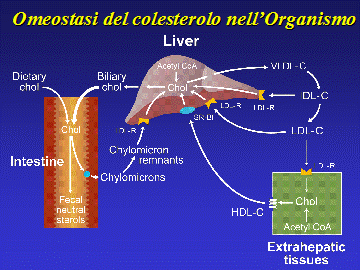 Figura
1
Figura
1
Ne consegue che un intervento farmacologico mirato a ridurre i livelli plasmatici di colesterolo LDL e mirato a modulare l’omeostasi del colesterolo stesso può esplicarsi sia a livello della sintesi epatica sia a livello dell’assorbimento di colesterolo intestinale.
Considerazioni farmacologiche
Inibitori della sintesi del colsterolo: statine
Gli inibitori della 3-idrossi-3-metilglutaril coenzima A (HMG-CoA) riduttasi, l’enzima chiave della via biosintetica del colesterolo, o statine, sono la classe di farmaci di elezione per il trattamento delle ipercolesterolemia e sono in grado di ridurre il rischio di morbilità e mortalità CV in pazienti a rischio, perfino in quelli con livelli normali di lipoproteine a bassa densità (LDL) (1,3). Le statine esercitano il loro effetto principale, la riduzione dei livelli di colesterolo LDL (LDL-C), inibendo competitivamente la HMG-CoA riduttasi e, quindi, la sintesi endogena di colesterolo a livello epatico. La ridotta disponibilità di colesterolo cellulare determina un aumento dell’espressione dei recettori per le LDL sulla superficie degli epatociti con una aumentata rimozione delle LDL circolanti, riducendo così i livelli plasmatici del LDL-C (3).
Effetti sui livelli di LDL-C
Le statine sono in grado di abbassare i livelli di LDL-C dal 20 al 55% a seconda del dosaggio e della statina somministrata.
L’analisi delle relazioni dose-risposta per tutte le statine dimostra che l’efficacia nel ridurre il LDL-C è lineare; i livelli di LDL-C si riducono del 6% ogni volta che la dose di statina viene raddoppiata, e l’effetto massimo sui livelli plasmatici di colesterolo viene raggiunto dopo 15-30 giorni dall’inizio del trattamento. Le statine sono efficaci in tutti i pazienti con livelli elevati di LDL-C, e con pari efficacia, anche nei pazienti normocolesterolemici. Fanno eccezione i pazienti affetti da ipercolesterolemia famigliare omozigote che rispondono poco alle dosi abituali di statine poiché entrambi gli alleli del gene del recettore per le LDL codificano per recettori inattivi; la risposta parziale che si osserva (con una riduzione fino al 25% dei livelli di LDL-C) è dovuta a una riduzione della sintesi epatica di VLDL associata all’inibizione della sintesi del colesterolo mediata dalla HMG-CoA riduttasi (3).
Studi clinici
Effetti cronici delle statine
Numerosi studi clinici controllati, sia di prevenzione primaria sia secondaria, hanno documentato l’efficacia delle statine nel ridurre gli eventi CV fatali e non fatali, l’ictus e la mortalità totale. Il trattamento con le statine ha determinato una riduzione media dei livelli plasmatici di LDL-C del 30 % associata ad una simile riduzione media dell’incidenza sia delle morti coronariche sia dei casi non fatali di infarto del miocardio.
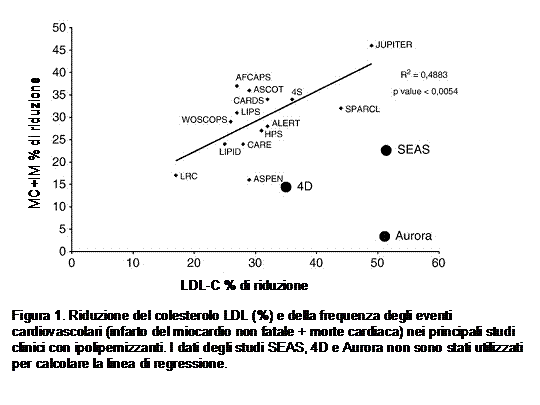
Come mostrato nella Figura 1, il beneficio clinico e’ in relazione diretta con l’abbassamento delle LDL (4), ad evidenziare che gli effetti pleiotropici delle statine, inclusi gli effetti antiinfiammatori (e.g. abbassamento della PCR) sono da attribuirsi essenzialmente alla riduzione delle LDL che di per se sono infiammatorie. Inoltre questi studi clinici hanno documentato come il trattamento con statine possa determinare riduzioni significative del LDL-C fino ad un 50%, a cui si associa una riduzione degli eventi cardiovascolari del 40-45%. Lo studio JUPITER ha evidenziato come il raggiungimento di livelli di LDL-C nell’intorno dei 50 mg/dl sia associato ad una riduzione significativa degli eventi CV nei pazienti con rischio CV moderato e caratterizzati da livelli normali di LDL-C ma da elevati livelli di PCR. E’ importante ricordare che tutti gli studi di intervento condotti a tutt’oggi con statine, compreso lo studio JUPITER, hanno alla base della riduzione degli eventi clinici esclusivamente la riduzione del LDL-C. Ne consegue che abbassare il LDL-C in modo importante e significativo si associa effettivamente ad una riduzione del rischio CV.
Un recente studio di meta-analisi su più di 170000 pazienti ha dimostrato che le statine, per ogni ulteriore riduzione di 1 mmole/L (~40 mg/dL) di LDL-C, riducono di circa un quinto il rischio di infarto, rivascolarizzazione e ictus ischemico (1). Non è stata dimostrata l’esistenza di alcun valore soglia all’interno dell’intervallo dei livelli di colesterolo studiati, facendo ipotizzare che una riduzione del LDL-C di 2-3 mmoli/L porterebbe ad una riduzione del rischio di circa il 40-50%, senza un aumento del rischio di cancro o morti non CV (1).
Effetti acuti delle statine
Recenti dati sembrerebbero confermare che gli effetti pleiotropici (indipendenti dall’abbassamento del colesterolo) delle statine possono avere un ruolo rilevante dopo un trattamento precoce e con dosaggi importanti di statine quali atorvastatina 80 mg, nei pazienti con sindrome coronarica acuta. Studi recenti dimostrano una minor incidenza di infarto periprocedurale e un periodo prolungato senza eventi cardiaci dopo l’intervento di PCI a seguito della somministrazione di statine entro le 48 ore dall’evento (5). Una ipotesi recente ipotizza un ruolo del fegato nel mediare gli effetti pleiotropici delle statine (6). Gli effetti pleiotropici delle statine si manifesterebbero grazie ad una azione inibitoria diretta delle statine a livello epatico sulla sintesi e secrezione di mevalonato e dei suoi derivati isoprenici. Questi effetti inibitori sui livelli sierici di mevalonato e dei suoi isoprenoidi si manifestano poche ore dopo la somministrazione delle statine, mentre l’abbassamento dei livelli di LDL-C si inizia a manifestare solo dopo 24-48 ore. Questa finestra terapeutica (entro 1-2 giorni) dopo la somministrazione della statina rappresenta un momento importante per esaltare gli effetti pleiotropici nei pazienti con sindrome coronaria acuta indipendenti dall’abbassamento del colesterolo (5)
L’impiego delle statine oggi è ben consolidato e l’inizio della terapia permette di portare la maggior parte (>65%) dei nostri pazienti a quei livelli soglia di LDL raccomandati (7). Tuttavia, l’adesione al trattamento con statine risulta critica e si evidenza che più del 50% dei pazienti smette di utilizzare in modo appropriato le statine dopo 3-6 mesi dall’inizio della terapia (8). Questo dato è molto preoccupante in quanto studi recenti hanno dimostrato che la scarsa aderenza al trattamento con statine ed il mancato mantenimento dei valori soglia (abbandono) comporta un aumentato rischio CV (9).
Le motivazioni di questo fallimento terapeutico sono svariate tra cui terapie concomitanti, fattori genetici, ed effetti collaterali, È noto come elevati dosaggi di statine siano associati ad aumentato rischio di miopatie, dei livelli degli enzimi epatici (3), di insorgenza di diabete di tipo 2 (10) ed anche della mortalità non CV (11). Queste ultime considerazioni suggeriscono come una terapia combinata sia potenzialmente più favorevole rispetto ad una terapia con dosaggi elevati di statine nel ridurre il colesterolo LDL.
Inibitori dell’assorbimento del colsterolo: ezetimibe
L’assorbimento del colesterolo proveniente dalla dieta prevede un meccanismo specifico mediato da una proteina trasportatrice localizzata a livello dell’orletto a spazzola degli enterociti, la proteina Niemann-Pick C1 Like 1 Protein (NPC1L1) fondamentale nel controllare l’omeostasi del colesterolo. In particolare, la sua espressione è modulata dal contenuto intracellulare di colesterolo nell’enterocita. È bene ricordare che il colesterolo presente nell’intestino deriva solo parzialmente dalla dieta e per la maggior parte ha origine endogena (12).
L’ezetimibe inibisce in modo specifico l’attività della proteina trasportatrice NPC1L1 impedendo così il trasferimento del colesterolo dal lume intestinale all’interno della cellula e favorendone l’escrezione per opera di altri trasportatori. L’inibizione a livello dell’orletto a spazzola evita tutte quelle interazioni che sono state documentate con l’impiego dei sequestranti degli acidi biliari (resine) che impediscono l’assorbimento non solo di acidi biliari, ma anche di una serie di molecole lipofile di notevole importanza biologica quali vitamine liposolubili e ormoni steroidei (13).
Razionale dell’impiego della combinazione statine-ezetimibe per il raggiungimento degli obiettivi di LDL-C
Il trattamento con statine, associata all’inibizione della sintesi di colesterolo, determina una risposta omeostatica dell’organismo alla necessità di colesterolo che si traduce in un aumento della quota di colesterolo assorbito. Per ottenere un controllo ottimale dei livelli plasmatici di colesterolo è necessario quindi un duplice effetto di inibizione dell’assorbimento e dell’aumentata sintesi endogena di colesterolo. Numerosi studi clinici hanno dimostrato l’efficacia di ezetimibe 10 mg/die nell’aumentare del 15-26% l’effetto ipolipemizzante di qualsiasi statina (14). Questo approccio consente di portare e mantenere un maggior numero di pazienti a quei valori soglia LDL raccomandati per un controllo ottimale del rischio CV soprattutto a livello ambulatoriale.
Riassumendo, la doppia inibizione, a livello dell’enterocita operata da ezetimibe e a livello
dell’epatocita dalla statina, costituisce l’approccio terapeutico ottimale delle dislipidemie proprio per le diverse caratteristiche farmacodinamiche dei due agenti terapeutici e per la selettività della loro azione (3). Lo studio SHARP (Study of Heart and Renal Protection ) (15), condotto in 9,270 pazienti (di cui 3.023 dializzati) trattati con ezetimibe/simvastatina 10/20 mg vs placebo, ha permesso di documentare che il trattamento ha ridotto sia gli eventi vascolari maggiori del 16.1% (p=0,0010) sia gli eventi aterosclerotici maggiori del 17,0 % (p= 0,0022). Il trattamento con l'associazione ezetimibe/simvastatina è ad oggi l'unico trattamento che abbia dimostrato un beneficio clinico in questa tipologia di pazienti.
E’ importante notare (Figura 2) che la relazione tra riduzione del LDL-C e riduzione degli eventi vascolari è in accordo con i risultati di tutti gli altri studi clinici condotti con statine in diverse tipologie di pazienti (e.g. diabetici, ipertesi, coronaropatici, dislipidemici) a sottolineare che l’obiettivo della terapia ipolipemizzante è l’abbassamento del LDL-C sia in monoterapia sia in combinazione.
Riduzione del LDL-C
(mmoli/L) Riduzione del LDL-C
(mmoli/L) Eventi vascolari
maggiori Eventi coronarici
maggiori Relazione tra la riduzione proporzionale
dell’incidenza degli eventi coronarici e vascolari maggiori e la riduzione
assoluta del LDL-C ad 1 anno
![]()
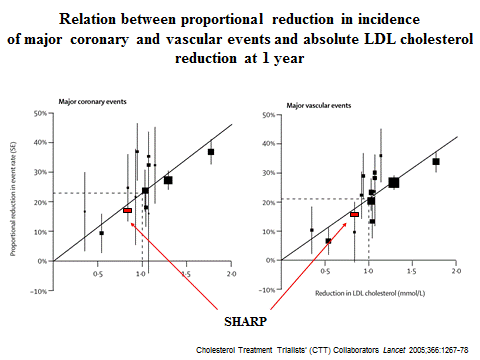
Figura 2
Riassumendo, le attuali conoscenze sulla terapia ipocolesterolemizzante evidenziano l’importante contributo clinico, in particolare delle statine, nei pazienti ad alto rischio CV ma sottolineano come la terapia di combinazione con ezetimibe rappresenti un’importante opzione terapeutica come documentato da numerose evidenze del beneficio clinico dell’associazione. Il razionale farmacologico dell’intervento sia sulla sintesi epatica sia sull’assorbimento intestinale ha effettivamente permesso di ottimizzare l’intervento ipocolesterolemizzante, di favorire il raggiungimento dei livelli di LDL raccomandati dalle Linee Guida e di ridurre il rischio cardiovascolare dei pazienti trattati.
BIBLIOGRAFIA
- Catapano AL et al. ESC/EAS Guidelines for the management of dyslipidaemias The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Atherosclerosis. 2011 Jul;217(1):3-46
- J. Shepherd. Combined lipid lowering drug therapy for the effective treatment of hypercholesterolaemia. European Heart Journal 2003;24:685-689
3. Bersot T Drug Therapy for Hypercholesterolemia and Dyslipidemia. Goodman & Gilman's The Pharmacological Basis of Therapeutics, 12e. Laurence L. Brunton, Bruce A. Chabner, Björn C. Knollmann New York: McGraw-Hill; 2011 pp 877-908
4. Poli A, Corsini A. Reversible and non-reversible cardiovascular risk in patients treated with lipid-lowering therapy: analysis of SEAS and JUPITER trials. Eur J Intern Med;21:372-373.
5. Patti G, Pasceri V, Colonna G, Miglionico M, Fischetti D, Sardella G, Montinaro A, Di Sciascio G. Atorvastatin pretreatment improves outcomes in patients with acute coronary syndromes undergoing early percutaneous coronary intervention: results of the ARMYDA-ACS randomized trial. J Am Coll Cardiol. 2007;49:1272-1278.
6. Arnaboldi L, Corsini A Do structural differences in statins correlate with clinical efficacy? Current Opinion in Lipidology 2010, 21(4):298-304.
7. Santos RD et al. Low- and high-density lipoprotein cholesterol goal attainment in dyslipidemic women: The Lipid Treatment Assessment Project (L-TAP) 2Am H J 2009; 158 (5): 860-866
8. Perreault S et al, Persistence and determinants of statin therapy among middle-aged patients free of cardiovascular disease. Eur J Clin Pharmacol 2005; 61:667-674
9. Rasmussen JN et al. Relationship Between Adherence to Evidence-Based Pharmacotherapy and Long-term Mortality After Acute Myocardial Infarction JAMA. 2007;297:177-186
10. Preiss D et al. Risk of Incident DiabetesWith Intensive-Dose Compared With Moderate-Dose Statin Therapy JAMA. 2011;305(24):2556-2564
11. LaRosa J et al. Intensive Lipid Lowering with Atorvastatin in Patients with Stable
Coronary Disease N Engl J Med 2005;352:1425-1435
12. Jia L et al. Niemann-Pick C1-Like 1 (NPC1L1) Protein in Intestinal and Hepatic
Cholesterol Transport Annu. Rev. Physiol. 2011. 73:239–259
13. Altmann SW et al. Niemann-Pick C1 Like 1 Protein Is Critical for Intestinal
Cholesterol Absorption. Science 2004; 303: 1201-1204
14. Anne C. Goldberg et al., Efficacy and safety of ezetimibe coadministered with simvastatin in patients with primary hypercholesterolemia: a randomized, double-
blind, placebo-controlled trial. Mayo Clin Proc 2004;79:620-629
15. Baigent C et al The eff ects of lowering LDL cholesterol with simvastatin plus
ezetimibe in patients with chronic kidney disease (Study of Heart and Renal
Protection): a randomised placebo-controlled trial Lancet 2011; 377: 2181–2192