ESISTE UNA ETA’ OLTRE LA QUALE NON IMPIANTARE
UN DEFIBRILLATORE IMPIANTABILE?
Alessandro Boccanelli, Alessandro Battagliese
A.O. San Giovanni Roma
Keywords: Heart Failure, Defibrillator, Cardiac resynchronization, elderly
La morte cardiaca improvvisa (MCI) secondaria a tachiaritmie ventricolari (TV) è una delle più frequenti cause di morte nei pazienti con scompenso cardiaco (SC) in tutto il mondo. La disfunzione ventricolare sinistra, indipendentemente dalla sua eziologia (ischemica e non ischemica) rappresenta il principale substrato delle TV, la cui manifestazione è inversamente proporzionale, in termini di incidenza, al valore di frazione di eiezione. ([i]-[ii]).
L’incidenza , la prevalenza e la mortalità dello SC aumentano con l’aumentare dell’età. Pazienti di età compresa tra i 75-85 anni hanno un rischio 2 volte superiore di SC rispetto a quelli di età compresa tra 65-75 anni; la popolazione utraottantacinquenne ha un rischio , addirittura, 4 volte superiore. La prevalenza dello SC è del 10-20% nella popolazione untrasettantacinquenne (2-3% la prevalenza nella popolazione totale) con un tasso di mortalità ad 1 anno aumentato del 60-70% per decade di età.([iii]-[iv]-[v])
L’introduzione ed il successivo impiego del defibrillatore impiantabile (ICD) nei pazienti con SC rappresenta una delle terapie più efficaci in termini di prevenzione della MCI in categorie selezionate di pazienti.Le indicazioni al suo utilizzo derivano essenzialmente da studi clinici randomizzati, da studi osservazionali su popolazioni di pazienti ad alto rischio e da opinioni di esperti su potenziali benefici in determinate condizioni cliniche in presenza di dati incerti o limitati.
Le linee guida europee raccomandano in 1° classe con livello di evidenza A l’impianto dell’ICD in prevenzione secondaria in pazienti con frazione di eiezione (FE) < 40% in terapia medica ottimale e sopravvivenza > ad 1 anno e con la stessa classe di raccomandazione in prevenzione primaria dopo 40 giorni da infarto miocardico acuto in presenza di FE < 35% e classe funzionale NYHA 2-3 (livello di evidenza A) e nella cardiopatia ad eziologia non ischemica con identici valori di FE e classe NYHA (livello di evidenza B) ([vi])
Tuttavia le linee guida presentano delle grosse limitazioni in quanto si basano su pochi studi clinici randomizzati e meta-sottoanalisi, considerano prevalentemente la FE quale parametro discriminante e risultano alquanto generiche su quali siano i casi in cui non ricorrere a questo genere di terapia.
In particolare non è ben chiaro come caratterizzare in termini quantitativi l’aspettativa di vita e lo stato funzionale dei pazienti candidabili ad ICD, lasciando la valutazione all’interpretazione soggettiva del clinico.
Inoltre, nonostante le evidenze scientifiche fornite dai trial clinici randomizzati a favore dell’utilizzo dell’ICD, il loro impiego su larga scala è ancora dibattuto ([vii]) anche per i costi e per i rischi correlati alla procedura.
I primi studi in cui è stata dimostrata l’efficacia dell’ICD in termini di riduzione della mortalità sono quelli di prevenzione secondaria in pazienti con cardiopatia ischemica cronica e disfunzione ventricolare sinistra.([viii]-[ix]-[x])
Successivamente gli studi MADIT e MUSTT ([xi]-[xii]), su pazienti con cardiopatia ischemica cronica, disfunzione ventricolare sinistra e documentazione di tachicardie ventricolari non sostenute o TV indotte allo studio elettrofisiologico, hanno dimostrato una significativa riduzione della mortalità nei portatori diICD in prevenzione primaria. La FE era < 35% nel primo studio e < 40% nel secondo. Un sottostudio del MADIT pubblicato successivamente ha evidenziato come il beneficio dell’ICD era limitato ai soli pazienti con FE < 26%.([xiii])
Lo studio MADIT 2 ([xiv]) che ha arruolato pazienti ad 1 mese dall’evento coronarico acuto e con FE < 30% è stato quello da cui è stata estrapolata l’indicazione delle linee guida all’impianto dell’ICD in prevenzione primaria nella cardiopatia ischemica.
Sebbene nessuno di questi studi avesse tra i criteri di inclusione lo SC, circa 2/3 della popolazione arruolata ne era affetta, con una classe funzionale NYHA prevalentemente 2° e 3°.
Gli studi successivi,pertanto, sono stati disegnati arruolando pazienti con SC sintomatico (classe NYHA 2 e 3) ed eziologia non ischemica dimostrando un beneficio, seppur minore, anche in questa categoria di pazienti ([xv]-[xvi]).
Nello studio DEFINITE, che arruolava pazienti non ischemici con FE < 35%, la riduzione di mortalità nel follow-up a 2 anni era maggiore nel gruppo randomizzato ad ICD rispetto a terapia medica convenzionale,ma non raggiungeva la significatività statistica. (15)
Lo studio SCD-HeFT pubblicato nel 2005, è l’unico studio effettuato su ampia popolazione randomizzata che ha dimostrato un vantaggio in termini di riduzione di mortalità, statisticamente significativo (HR 0.77; 97.5% CI , 0,62-0.96; p=0.07) con una riduzione assoluta di 7 punti percentuali a 5 anni dall’impianto di ICD in pazienti ischemici e non, con FE <35% e SC sintomatico in classe funzionale NYHA 2° e 3°, rispetto alla terapia medica convenzionale, indipendentemente dall’impiego di amiodarone . L’età media della popolazione era di circa 60 anni.(16)
Sui dati fin qui esposti si basano le attuali raccomandazioni delle linee guida.
In realtà la popolazione di pazienti arruolata in questi trial è relativamente giovane con età media compresa tra i 52 e i 64 anni, mentre i dati sul beneficio dell’ICD nei pazienti più anziani sono pochi e controversi.
L’interazione tra età avanzata ed efficacia dell’ICD è caratterizzata da due fattori fondamentali: 1) i pazienti anziani presentano maggiori co-morbidità per cui la mortalità , con l’avanzare dell’età risulta sempre meno dipendente da eventi tachiaritmici (unico target terapeutico del defibrillatore impiantabile); 2) l’incidenza e la prevalenza dello SC e la mortalità ad esso correlata aumentano proporzionalmente all’età per cui qualsiasi terapia efficace in questo senso (come l’ICD ad esempio) potrebbe avere un impatto favorevole sulla sopravvivenza in questa popolazione.
La necessità di trattamenti sempre più costo-efficaci, motivati dalle limitate risorse, impone, tuttavia, una riflessione accurata sull’effettivo beneficio di questi DEVICE nella popolazione anziana sempre più numerosa per via del progressivo allungamento della vita, tenendo sempre presente che l’ICD riduce la morte improvvisa aritmica, non la mortalità totale (MT).
Krahn et al.([xvii]), nel 2004, utilizzando i dati dell’ Amiodarone Trialists MetAnalisis database su 6252 pazienti con SC ischemico e non e disfunzione ventricolare sinistra, hanno calcolato un indice, il MCI/ MT dividendo la popolazione in quintili per età (< 50 aa; 51-60 aa, 61-70 aa, 71-80 aa e >80aa). Pur notando un aumento di entrambe le morti con l’avanzare dell’età, il rapporto diminuiva progressivamente ed in maniera lineare tra i 50 e gli 80 aa, a dimostrazione del fatto che la MCI rappresenta la principale causa di morte nei pazienti più giovani con SC ed infarto, ma non i quelli più anziani, per i diversi meccanismi patogenenetici alla base. Il rapporto non si modificava normalizzando i dati per sesso, classe NYHA e frazione di eiezione.
Recentemente è stata pubblicata una metanalisi sull’efficacia dell’ICD in prevenzione primaria nei pazienti ultra 65 enni e ultra 75 enni.[xviii]
Sono stati analizzati i 5 studi più importanti sull’ICD: il MADIT, il MUSTT, il MADIT 2, il DEFINITE e lo studio SCD-HeFT.
L’impianto di ICD in prevenzione primaria si associava ad una significativa riduzione, del 40%, di mortalità totale nei pazienti ultra sessantenni e del 27% nei pazienti ultrasettantacinquenni.
Tuttavia da una revisione critica della metanalisi si può osservare come i pazienti anziani randomizzati non fossero rappresentativi della popolazione del mondo reale, essendo stati esclusi dagli studi quelli con co-morbilità più pesanti tra cui l’insufficienza renale avanzata. Inoltre il numero di ultraottantenni e ultranovantenni era molto limitato. Non è stata effettuata un’ analisi multivariata al fine di valutare il peso delle singole co-morbilità sulle variabili cliniche nè una distinzione tra MCI e mortalità totale. Infine bisogna considerare l’inadeguatezza intrinseca degli studi metanalitici e la loro limitata applicabilità nel mondo reale.
In 500 pazienti consecutivi arruolati nel Marburg Defibrillator database ([xix]) l’8% (40 pazienti) avevano più di 75 aa mentre il 92% aveva meno di 75 aa. La mortalità per morte improvvisa a 5 anni risultava minore nel primo gruppo, con un significativo incremento della mortalità totale per scompenso cardiaco. Non vi erano differenze nel tasso di complicanze correlate al DEVICE nelle due popolazioni.
Questi dati sono stati confermati su un piccolo gruppo di ultraottantenni in cui Noseworthy et al.([xx]) non hanno documentato differenze in termini di complicanze ICD correlate rispetto ad una popolazione relativamente più giovane (70-79aa).
Duray et al, al contrario, hanno riscontrato valori di sopravvivenza sovrapponibili in 375 pazienti suddivisi in due gruppi in base all’età (al di sopra ed al di sotto di 70 aa); tuttavia è verosimile che questi risultati risentano del minor peso delle comorbilità nel gruppo di pazienti ultrasettantenni arruolati nello studio, non rappresentativo, della popolazione reale.([xxi])
Le linee guida, ricordiamo, non pongono limitazioni di età all’impianto di ICD se non un’ aspettativa di vita e un buono stato funzionale > 1 anno.
Se consideriamo l’aspettativa di vita in coloro che raggiungono gli 80 aa , questa risulta essere di 8 anni per le donne e 6 anni per gli uomini.
Ma tutto questo è valido a livello individuale? In particolare come è possibile quantificare lo stato funzionale di un singolo individuo e come quantificarne le comorbidità?
Se la riduzione del rischio di morte con ICD si ottiene dopo 2 anni (14-16) come è possibile individuare la popolazione di pazienti ultraottantenni con requisiti tali da avere una prospettiva di vita tale beneficiare dell’impianto del DEVICE?
Lo studio DINAMIT ([xxii]) pubblicato nel 2004 non ha mostrato nessun beneficio dall’impianto di ICD precoce in prevenzione primaria dopo infarto miocardico in pazienti ad alto rischio e nessun beneficio a 30 mesi di FU con un tasso di morte non improvvisa più elevato nel gruppo di pazienti randomizzati ad ICD. L’assenza di un vantaggio precoce sulla sopravvienza conferito dall’ICD (14-16) è da ricercare nel relativo basso rischio di morte improvvisa precoce nella popolazione di pazienti trattati con ICD e nell’elevato rischio di morte cardiaca non improvvisa ad 1 anno dall’impianto. Nel 2006 Parkash et al. ([xxiii]) sulla base di queste ipotesi hanno condotto uno studio retrospettivo su circa 470 pazienti consecutivi sottoposti ad impianto di ICD. E’ stato creato uno score di rischio utilizzando come variabili l’età, la classe NYHA, l’insufficienza renale, la presenza o meno di fibrillazione atriale in anamnesi, la durata del QRS, la presenza di malattia coronarica e la presenza di altre comorbidità tra cui: polmoniti o altri processi infettivi durante ricovero, tumori, demenza o esiti neurologici di patologia cerebrovascolare.
Dall’analisi multivariata l’età > 80 aa, l’insufficienza renale con creatinina > 1,8, la storia di fibrillazione atriale e la classe NYHA avanzata risultavano essere i predittori indipendenti più pesanti di morte ad 1 anno.
Attribuendo un punteggio di 1 ad ognuna di queste variabili è stato creato uno score; la popolazione con un score di rischio superiore a 2 era quella con maggiore mortalità precoce (1 aa di FU) e, pertanto, quella che traeva meno vantaggio dall’ICD. L’età media della popolazione studiata era di 65 aa.
Quindi l’utilizzo di uno score di rischio potrebbe identificare pazienti ad alto rischio di morte precoce dopo impianto di ICD favorendo una maggiore selezione dei candidati a DEVICE.
Questi dati sono stati confermati su popolazioni più numerose.
Lee et al.([xxiv]) hanno effettuato uno studio di comunità su una popolazione di circa 2500 pazienti sottoposti ad impianto di ICD appartenenti ad un registro canadese confrontandone la sopravvivenza con un gruppo di controllo. In particolare hanno suddiviso in terzili il campione di studio in base all’età: 18-64 aa; 65-74 aa; >75 aa. Dall’analisi univariata i pazienti ultrasettantacinquenni presentavano una mortalità totale di circa 3,3 volte superiore rispetto alla popolazione di età inferiore a 65 aa. con incremento dell’HR non lineare ma curvilineo in quelli con più di 70 aa.
Anche in questo studio è stato confermato il peso delle comorbilità ed in particolare dell’insufficienza renale. I pazienti in dialisi presentavano una sopravvivenza a 2 anni ridotta dopo impianto di ICD con un tasso di mortalità del 50%.
Di recente uno studio retrospettivo americano ha sottolineato l’importanza della frazione di eiezione pre impianto, in ultraottantenni candidati ad ICD.
Pur riscontrando valori di sopravvivenza media buoni (3,6 aa) tali da rendere vantaggioso l’impianto di defibrillatore oltre gli 80 aa, è stata effettuata un’analisi multivariata dividendo il campione studiato per valori di FE utilizzando come cut off un valore di 20% . L’età avanzata, (> di 80aa) e la FE particolarmente compromessa caratterizzava un sottogruppo in cui il vantaggio derivante dall’impianto di ICD svaniva a causa di una drammatica riduzione della sopravvivenza ad 1 anno, dimezzata rispetto al sottogruppo con frazione di eiezione superiore (valori di mortalità ad 1 anno pari al 40%).
La frazione di eiezione inferiore al 20% sembrerebbe caratterizzare un sottogruppo di pazienti tra gli ultraottantenni con mortalità totale a 12 mesi significativamente aumentata, in cui l’impianto di ICD non conferirebbe alcun beneficio.([xxv])
Frazione di eiezione e compromissione renale si sono confermati principali predittori di mortalità in pazienti ultraottantenni anche nello studio restrospettivo di Koplan et al.([xxvi]). La sopravvivenza media dei pazienti ottuagenari sottoposti ad impianto di ICD era di circa 4 anni a differenza di quella della popolazione di pazienti di età compresa tra 60 e 70 che era di circa 7 anni. I ricercatori hanno individuato quali predittori indipendenti di morte la frazione di eiezione e il filtrato glomerulare. La loro assenza permetterebbe di identificare pazienti ottuagenari con sopravvivenza simile alla popolazione più giovane mentre la loro presenza contemporanea individuerebbe un sottogruppo con sopravvivenza di molto più bassa (inferiore a 2 anni). Dividendo la popolazione ultraottentenne in quartili per filtrato glomerulare, i ricercatori hanno notato la sopravvivenza più bassa (di circa 1,5 anni) in quei pazienti con un filtrato inferiore a 41 ml/min.
Quindi da questi dati ed in considerazione delle evidenze fornite dallo studio MADIT 2 in cui le curve di sopravvivenza iniziavano a divergere dopo 9 mesi ma in modo significativo solo dopo 2 anni, l’utilizzo dell’ICD non sembrerebbe vantaggioso in pazienti ultraottantenni con bassa frazione di eiezione ed insufficienza renale avanzata.
I ricercatori dello Studio MADIT 2 nel 2008 ([xxvii]), volendo studiare il peso delle comorbidità sul decorso clinico dopo impianto di ICD, a parità di disfunzione ventricolare sinistra, pubblicano un sottostudio in cui dividono la popolazione MADIT in 2 gruppi: un gruppo (60 pazienti) ad alto rischio (caratterizzato da significativa compromissione della funzione renale con Azotemia BUN > 50 mg/dl e/o creatininemia > 2,5 mg/dl) ed in uno a basso rischio. In quest’ultimi, tra quelli in terapia medica convenzionale, individuano 5 fattori di rischio predittori indipendenti di mortalità totale all’analisi multivariata, ed elaborano uno score.
Nello specifico vengono presi in considerazione: classe NYHA >2, età >70, BUN > 26<50 mg/dl, QRS > 120 msec, storia di fibrillazione atriale.
Nel gruppo di pazienti ad alto rischio (quelli con compromissione renale più severa) non vi era alcun beneficio in termini di sopravvivenza tra terapia convenzionale e ICD con una mortalità totale a 2 anni di circa il 50% in entrambi i gruppi.
Nel sottogruppo di pazienti a basso rischio (1/3 della popolazione) in terapia medica convenzionale, la mortalità a 2 anni era di solo l’8%; l’impianto di ICD non determinava beneficio ulteriore. Al contrario i pazienti con più di 1 fattore di rischio (score >1) (circa la metà della popolazione) avevano una mortalità 4 volte superiore; in questi l’impianto di ICD si associava ad un significativo beneficio (mortalità a 2 anni ridotta del 50% dall’ICD). Nel gruppo di pazienti con score superiore a 3 il beneficio conferito dall’ICD era molto più modesto e non raggiungeva la significatività statistica.
Quindi, in base a questi risultati, il beneficio conferito dall’ICD a 2 anni sembrerebbe nullo sia nei pazienti in a bassissimo rischio sia in quelli a rischio molto elevato, sempre in terapia medica ottimale, descrivendo una curva ad U molto caratteristica. Solo la popolazione a rischio intermedio è quella che trae un reale beneficio dall’impianto del defibrillatore (Fig. 1 A e B)
La spiegazione di questo fenomeno è da ricercare nel tipo di eventi fatali verificatisi nella popolazione randomizzata a terapia medica convenzionale. Dai dati pubblicati si nota come la morte improvvisa (l’unica in grado di essere prevenuta dall’ICD) risulti molto bassa nel sottogruppo di pazienti a bassissimo rischio (Score 0), aumenti nel sottogruppo con score 1 e 2 (popolazione a rischio intermedio) e si riduca nei pazienti a rischio molto elevato. In questa popolazione gli eventi fatali sono maggiormente di tipo non improvviso (Fig. 2 A e B).
Quindi tra la popolazione MADIT 2, su cui sono state costruite le evidenze scientifiche alla base delle raccomandazioni delle linee guida correnti , possiamo estrapolare una categoria di pazienti in cui il beneficio del defibrillatore sembrerebbe nullo e più precisamente in quelli a rischio molto basso ed in quelli a rischio molto alto caratterizzati da età superiore a 70 aa, maggiore compromissione cardiovascolare e numerose comorbidità (molto diffuse tra gli ultraottantenni). L’ICD conferirebbe, invece , massimo beneficio nei pazienti a rischio intermedio.
Ovviamente è necessario verificare questi dati in studi più numerosi. Il campione di pazienti a rischio molto elevato, infatti era costituito di soli 90 pazienti, anche per le caratteristiche di arruolamento dello studio MADIT 2.
In questo senso appaiono molto interessanti i dati emersi da un recente studio restrospettivo americano su ultraottantenni con disfunzione ventricolare sinistra sottoposti ad impianto di ICD in prevenzione primaria.
Il gruppo di studio era composto da 485 pazienti trattati con impianto di DEVICE tra il 2000 ed il 2008. Il gruppo controllo era costituito da pazienti di stessa età e con pari grado di disfunzione ventricolare sinistra trattati con sola terapia medica. Il follow up medio è stato di 2 anni con un massimo di 4.
Sono state studiate le comorbidità e, in base a queste, è stato costituito uno score attribuendo ad ognuna di esse un punteggio compreso tra 1 e 6 a secondo del loro peso e quindi della probabilità di morte ad essa correlata.
Durante il follow up la mediana di sopravvivenza è stata di 1,8 anni.
Il gruppo di studio (ICD) presentava una sopravvivenza maggiore ad un anno rispetto al gruppo controllo; tuttavia, dall’analisi multivariata, aggiustando i dati per età, frazione di eiezione, comorbidità, filtrazione glomerulare, non si osservava alcun vantaggio significativo in termini di sopravvivenza, nel gruppo di studio. L’età e la filtrazione glomerulare sono risultati essere predittori indipendenti di sopravvivenza.
In base a quanto detto risulta evidente come non sia stato, ancora, dimostrato in maniera rigorosa il reale beneficio di una procedura invasiva e costosa come l’impianto di ICD nella popolazione più anziana soprattutto in presenza di comorbidità plurime. Impiantare un ICD in ottantenni e novantenni non rappresenta altro se non una estrapolazione dei dati ottenuti dai grossi studi randomizzati effettuati su popolazioni in larga parte più giovani.
Dai dati in letteratura risulta evidente come i pazienti più anziani abbiano un rischio di morire di morte non aritmica più elevato, se non altro, per il maggior peso delle cormobilità, e che, pertanto, l’aspettativa di vita sia minore. Il problema rimane tuttavia individuare con precisione l’età a partire dalla quale viene perso il vantaggio fornito dall’ICD.
Discorso diverso per quanto riguarda l’impianto di pace maker biventricolare.
In circa 1/4 dei pazienti con scompenso cardiaco è presente dissincronia di contrazione evidenziabile mediante studio ecocardiografico. Essa è spesso conseguenza dell’allungamento dell’intervallo QRS secondario alla comparsa di blocco di branca sinistra. La terapia di resincronizzazione cardiaca (TRC) mediante stimolazione biventricolare o ventricolare sinistra è in grado di ovviare a tutto questo.
Studi clinici hanno dimostrato un significativo miglioramento dei sintomi correlati all’insufficienza cardiaca, della qualità di vita, della capacità di esercizio e della funzione ventricolare sinistra in popolazioni selezionate di pazienti sottoposti a terapia di resincronizzazione.([xxviii]-[xxix]-[xxx]-[xxxi])
Tuttavia anche per quanto riguarda la TRC, i dati in letteratura negli ultraottantenni sono molto limitati anche se, dai pochi disponibili, i benefici da essa derivanti, sembrerebbero indipendenti dall’età. ([xxxii])
Lo studio COMPANION (30) ha valutato la TRC con e senza ICD in circa 1500 pazienti con scompenso cardiaco avanzato e blocco di branca sinistra in aggiunta alla terapia medica ottimale. La TRC ha ridotto in maniera significativa la mortalità e le ospedalizzazioni per SC rispetto alla popolazione di pazienti in sola terapia medica. Sempre in questo studio l’analisi per sottogruppi ha dimostrato uguale beneficio sia in coloro di età inferiore che superiore ai 65 aa.
Lo studio CARE-HF (31) ha randomizzato circa 800 pazienti con SC in classe funzionale NYHA 3° o 4° e dissincronia cardiaca, a terapia medica ottimizzata o TRC (senza ICD). I ricercatori hanno osservato non solo un miglioramento della qualità di vita e dei sintomi ma anche una significativa riduzione della mortalità nel gruppo di pazienti randomizzati a CRT.
Anche in questo caso, l’analisi per sottogruppi ha dimostrato simili benefici a prescindere dall’età (cut off 66,4 aa).
Questi dati trovano conferma in alcuni studi osservazionali di piccole dimensioni su popolazione ultrasettantacinquenne affetta da SC.([xxxiii]-[xxxiv]) Nello specifico, in questi pazienti, la TRC determina miglioramento della qualità di vita, della capacità funzionale e dei sintomi come nella popolazione più giovane.
Da notare che questo beneficio si mantiene per almeno 1-2 anni il che assume una valenza davvero rilevante nella popolazione più anziana; infatti, a differenza dell’ICD, che aumenta la durata ma non la qualità di vita, la TRC ha come finalità quello di migliorare quest’ultima in quei pazienti ancora sintomatici per scompenso cardiaco nonostante terapia medica ottimizzata.
Il miglioramento della qualità di vita è sicuramente un obiettivo da perseguire in una popolazione come quella ultraottantenne la cui aspettativa di vita, come già ricordato, spesso non consente di beneficiare del vantaggio fornito dall’ICD.
A conferma di questo, recenti dati in letteratura suggeriscono come i pazienti anziani candidati a DEVICE scelgano maggiormente la sola TRC a differenza dei pazienti più giovani.([xxxv])
Rimane , tuttavia, ancora da chiarire il beneficio della TRC nella fibrillazione atriale, così come nella disfunzione diastolica, condizioni queste molto diffuse negli anziani; bisognerebbe anche considerare il peso delle possibili complicanze a lungo termine del trattamento di resincronizzazione e soprattutto quanto le molteplici comorbidità incidano sulla sua efficacia; infine non possono non essere presi in considerazione i costi, soprattutto rapportati ai benefici.
Per quanto riguarda i costi, gli effetti favorevoli della TRC sulla qualità della vita si traducono in un relativamente favorevole rapporto costo-efficacia. Nello Studio COMPANION, per esempio, il costo / QALY per TRC era di $ 19.600, mentre nel CARE-HF è stato di 19.320 € / QALY. La TRC da sola risultava conveniente per tutte le fasce di età, con costi simili sia nei pazienti di 55 anni che nei 75enni.([xxxvi]-[xxxvii])
A differenza, il costo medio di un impianto ICD negli Stati Uniti è di circa $ 45.000, esclusi i costi correlati alle eventuali complicazioni, relativamente più frequenti negli anziani. Diversi studi hanno valutato il rapporto costo-efficacia della terapia ICD, con valori che vanno da $ 35.000 a $ 131.000 per anno aggiustati per la qualità di vita (QALY) guadagnata per un paziente di 70 anni. Tuttavia, poiché i costi tendono ad essere più alti e la QALY più bassa nei pazienti di età superiore ai 80 anni, il rapporto costo-efficacia degli ICD in questa fascia di età risulta poco vantaggioso.([xxxviii]-[xxxix] )
Per quanto riguarda le possibili complicanze, Grimm et al. (18) analizzando 500 pazienti consecutivi sottoposti ad impianto di ICD ha notato come la frequenza di quest’ultime a lungo termine fosse la stessa sia in pazienti di età inferiore che superiore a 75 aa ( 25% contro 23 % p=ns). Tra queste vi erano complicanze correlate alla procedura, al generatore o all’elettrodo. La complicanza più frequente era rappresentata dagli shock inappropriati spesso causati da aritmie sopraventricolari rapide come fibrillazione o tachicardia atriale. Rare erano le complicanze perioperatorie caratterizzate da morte per insufficienza cardiaca, infezioni o stroke.
Per quanto riguarda le complicanze della TRC queste sono sostanzialmente le stesse a cui si aggiungono quelle secondarie a traumatismo del seno coronarico con conseguente possibile dissezione e perforazione con tamponamento pericardico. L’utilizzo di mezzo di contrasto per effettuare una venografia coronarica potrebbe determinare deterioramento della funzione renale nella popolazione anziana.
Complicanze sostanzialmente sovrapponibili e non dipendenti dall’età, e quindi non utilizzabili come discriminanti all’impianto di questi DEVICE nella popolazione più anziana.
Infine alcune considerazioni di carattere etico.
In molti studi in letteratura l’impianto di ICD e/o TRC è associato a miglioramento (o comunque assenza di peggioramento) della qualità di vita.([xl]-[xli]-[xlii]-[xliii]).
Fattori responsabili di un peggioramento della qualità di vita nei portatori di ICD sono le scariche ripetute del defibrillatore, i disturbi d’ansia preesistenti e le numerose comorbidità.
Tuttavia i pochi studi prospettici disponibili che si sono focalizzati sulla qualità di vita, non attribuiscono all’età di per sé, il ruolo di predittore indipendente negativo.(32-33)
Negli stadi più avanzati dello scompenso cardiaco o in tutte le altre condizioni morbose intrattabili è necessario disattivare l’ICD per evitare i multipli shock dolorosi durante lo storm aritmico terminale.
Tuttavia, non accade di frequente che medici, paziente e familiari discutano di questi aspetti al momento o dopo l’impianto del defibrillatore.
Tutto ciò sta diventando sempre più oggetto di discussione in ambito non solo medico ma anche legale.([xliv]-[xlv])
E’ descritto come i pazienti con ICD presentino una o più scariche dolorose del defibrillatore negli ultimi 30 giorni di vita, che contribuiscono non solo, in senso peggiorativo, alla sofferenza del paziente ma determinano, anche, un aumento dello stress tra i familiari.(44)
Di recente le società scientifiche, tra cui quella europea, hanno pubblicato delle linee guida in cui vengono sottolineati proprio gli aspetti di gestione del paziente terminale con ICD. ([xlvi]-[xlvii])
In particolare si sottolinea la necessità di affrontare questa tematica prima dell’impianto dell’ICD, chiedendo esplicitamente al paziente quali sono le circostanze in cui vorrebbe avere il DEVICE disattivato, mettendo il tutto per iscritto in presenza di un avvocato. Inoltre, questo tipo di orientamento andrebbe rivalutato periodicamente durante il decorso della malattia soprattutto in occasione di eventi peggiorativi.
Si sottolinea inoltre l’autonomia decisionale del paziente ed il diritto di ricevere o meno questa terapia e ugualmente di disattivarla.
Questi principi devono considerarsi validi per tutti i dispositivi siano essi defibrillatori, DEVICE di resincronizzazione o pace maker convenzionali.
Compito del medico è quello di rispettare la volontà del paziente soprattutto in casi terminali previo colloquio medico-paziente-familiare efficace e chiaro.
In conclusione, da quanto detto, emerge in maniera evidente la necessità di studi clinici osservazionali e ranzomizzati di più vaste proporzioni per definire meglio il ruolo di questi DEVICE nei pazienti anziani. Intanto, il loro uso deve essere necessariamente individualizzato, prendendo in seria considerazione, caso per caso, lo stato di salute globale del soggetto, la severità dei sintomi, le comorbidità, la prognosi a medio-lungo termine e, cosa più importante, le preferenze personali del paziente e le sue aspettative relative allo stile di vita (vivere di più o vivere meglio) e ,non ultimo, il desiderio di sottoporsi ad interventi terapeutici invasivi. Per raggiungere questi obiettivi, i medici devono dedicare il giusto tempo per discutere tali questioni con ogni paziente, fornire una valutazione realistica dei potenziali rischi e benefici della terapia proposta, accettare un certo grado di incertezza, e in caso si decida per l’impianto di ICD, guidare nella gestione dello stesso pazienti e familiari, soprattutto nelle condizioni terminali.
L'età avanzata di per sé è solo uno dei fattori da considerare nel processo decisionale dell’iter diagnostico-terapeutico di ogni singolo paziente, ma acquista sicura valenza perché impone al medico, più che mai, una corretta ed attenta valutazione del rapporto rischio-beneficio nonché di quelli che sono i desideri e le aspettative di ciascun singolo individuo, spingendosi al di là delle evidenze scientifiche, soprattutto quando queste risultano essere carenti o poco chiare.
FIGURE
Fig.1
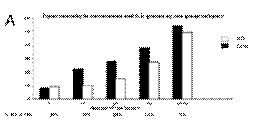
Fig. 1A : mortalità a 2 anni nel gruppo ICD (colonne bianche) e nel gruppo in terapia medica convenzionale (colonne nere). Modificato da Goldenberg I, et al J Am Coll Cardiol 2008; 51:288–96 (chiedere permessi)

Fig. 1B: curva ad “U” descrittiva della riduzione della mortalità a 2 anni dopo impianto di ICD in base allo score di rischio e nei pazienti ad altissimo rischio (VHR).Modificato da Goldenberg I, et al J Am Coll Cardiol 2008; 51:288–96 (chiedere permessi)
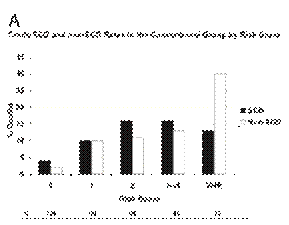
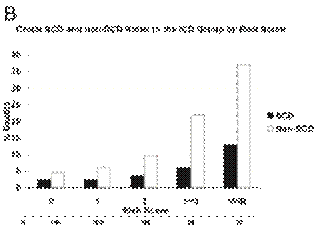
Fig 2: percentuali di morte improvvisa (colonne nere) e per tutte altre cause (colonne bianche)
calcolate come rapporto numero di morti per numero di pazienti per ogni categoria di
rischio nel gruppo di pazienti in terapia medica convenzionale (A) e nel gruppo di pazienti con ICD (B).
Modificato da Goldenberg I, et al J Am Coll Cardiol 2008; 51:288–96 (chiedere permessi)
BIBLIOGRAFIA