IL PUNTO DI VISTA DEL CARDIOLOGO INTERVENTISTA
Emilio Di Lorenzo, Giannignazio Carbone, Michele Capasso, Rosario Sauro
U.O. Emodinamica e Cardiologia Interventistica
A.O.R.N. San Giuseppe Moscati Avellino
INTRODUZIONE
Lo stroke è la terza causa di morte nel mondo occidentale ed è la principale causa di disabilità (1). Molti eventi cerebrali sono di natura ischemica e sono causati da fenomeni embolici a partenza da placche carotidee. L’incidenza di stenosi carotidee in pazienti asintomatici di età >65 anni è intorno al 10% ma solo l’1% presenta stenosi critiche. In questi pazienti il rischio di stroke è stimato fra 2-4% all’anno (2-4). Il rischio aumenta all’aumentare della criticità della stenosi o per la sua rapida progressione. I pazienti sintomatici hanno, al contrario, una prognosi peggiore rispetto ai pazienti asintomatici. Il verificarsi di un attacco ischemico transitorio (TIA) determina un rischio del 15% di stroke ad un mese e del 30% di TIA, stroke o morte a 3 mesi (5, 6). Infatti, in questi pazienti è consigliabile una strategia di rivascolarizzazione il più precoce possibile (2-4 settimane).
L’endoarterectomia carotidea (CEA) è da molti decenni considerata il trattamento di scelta nella prevenzione dello stroke in pazienti con rischio chirurgico medio-basso, sintomatici con stenosi >50% o asintomatici con stenosi >60%. (7-9). E’ di fondamentale importanza valutare il rischio perioperatorio nel caso di CEA. Infatti le società scientifiche consigliano la CEA se il rischio di stroke perioperatorio è <3% per i pazienti asintomatici ed <6% in pazienti sintomatici (10, 11). A tale scopo, sono stati identificati una serie di fattori clinici ed anatomici che determinano un aumentato rischio di stroke periprocedurale (Tabella 1).
Lo stenting carotideo (CAS) si è imposto come metodica alternativa alla CEA in quei pazienti in cui il rischio perioperatorio è alto. In realtà molti fattori di rischio operatorio sono simili per il CAS e la CEA ed inoltre il CAS ha alcuni suoi fattori di rischio periprocedurali come ad esempio l’età avanzata, un arco aortico di tipo III, le calcificazioni circumferenziali e la tortuosità della carotide comune. Tuttavia, è stato dimostrato che l’esperienza dell’operatore, l’attenta selezione e preparazione del paziente determinano un abbattimento significativo dei rischi periprocedurali dello stenting (12-15).
L’esperienza dell’operatore ed il volume di attività hanno un diretto impatto sui risultati periprocedurali (16-18). Nella lead-in phase dello studio CREST è stato osservato che i radiologi ed i cardiologi avevano circà la metà delle complicanze rispetto ai chirurghi vascolari e che questa differenza è stata annullata nelle fasi successive dello studio (18). Tre trials europei (EVA 3S, SPACE e ICSS) che avevano dato risultati negativi relativi al CAS, avevano coinvolto operatori molto inesperti (il 40% circa era in fase di addestramento anche durante la randomizzazione) (19-21).
Tabella 1: Fattori determinanti un alto rischio chirurgico
|
Fattori Anatomici |
Fattori Clinici
|
|
|
Stenosi intracraiche |
Età >80 anni |
|
|
Pregressa chirurgia del collo |
Scompenso Cardiaco NYAH III/IV |
|
|
Pregressa irradiazione del collo |
Angina pectoris CCS III/IV |
|
|
Precedente CEA ipsilaterale |
Stenosi del Tronco Comune |
|
|
Paralisi nel nervo laringeo controlaterale |
Coronaropatia multivasale |
|
|
Tracheostomia |
Necessità di cardichirurgia urgente |
|
|
Occlusione carotide controlaterale |
FE < 30% |
|
|
|
Recente IMA (< 30 giorni) |
|
|
|
BPCO severa |
|
|
|
IRCA moderato-severa |
CAS IN PAZIENTI AD ALTO RISCHIO CHIRURGICO
L’impianto di stent è l’indicazione principale in pazienti con stenosi critiche sintomatico o non ad alto rischio chirurgico. Il trial randomizzato SAPPHIRE è l’unico che ha confrontato la CES ed il CAS in pazienti con aumentato rischio chirurgico (22). Due caratteristiche di tale trial sono da sottolineare, ovvero, nel CAS era previsto l’utilizzo di sistemi di protezione embolica (EPD) ed i centri che randomizzavano i pazienti erano tutti con operatori esperti sia nel braccio CEA (15 -100 CEA per operatore all’anno) che nel braccio CAS (20 -700 CAS per operatore). Relativamente all’utilizzo degli EPD, sebbene non esistono trial randomizzati che hanno specificatamente testato questi devices, è importante sottolineare che le evidenze della efficacia della protezione embolica è supportata comunque da una corposa letteratura (23) tanto che negli US l’FDA ne raccomanda l’utilizzo e il sistema sanitario non rimborsa stenting carotidei eseguiti in assenza di EPD. Il SAPPHIRE ha dimostrato una riduzione significativa dell’end point primario (morte, stroke ed infarto a 30 giorni) nel braccio CAS . Successivi registri, hanno dimostrato in questa popolazione di pazienti una incidenza di stroke, morte ed infarto inferiori alle soglie raccomandate del 6% per pazienti sintomatici e 3% per pazienti asintomatici (11, 24)(Figura 1).
CAS IN PAZIENTI A RISCHIO CHIRURGICO MEDIO-BASSO
Quattro trial hanno confrontato la CEA con il CAS in pazienti non ad alto rischio, tre trials europei, ovvero l’EVA 3S (19) , lo SPACE (20) e l’ICSS (21) ed uno effettuato in Canada e U.S., il CREST (25) (Tabella 2). I tre trials europei
Tabella 2: Trials CAS vs CEA in pazienti non ad alto rischio chirurgico
|
|
STROKE E MORTE A 30 giorni |
MINIMA ESPERIENZA |
|
|
|||
|
|
CEA (%) |
CAS (%) |
CEA (n) |
CAS (n) |
EPD |
||
|
SPACE |
6,3 |
6,8 |
25 |
10 |
Non richiesto |
||
|
EVA 3S |
3,9 |
9,6* |
25 |
5 |
Non richiesto |
||
|
ICCS |
4,0 |
7,4* |
50 |
<10 |
Non richiesto |
||
|
CREST |
4,5 |
5,2 |
50 |
20 |
Richiesto |
||
*p<0,01
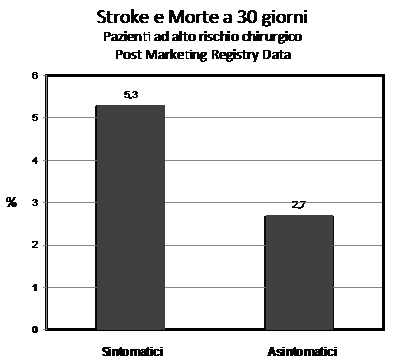
Figura 1
Risultati dell stenting carotideo in pazienti ad alto rischio chirurgico dai registri post-marketincg (EXACT, CAPTURE 2, SAPPHIRE registry)
hanno arruolato solo pazienti sintomatici ed hanno consentito di randomizzare nel braccio CAS anche ad operatori non esperti o sotto tutoraggio ed inoltre l’utilizzo degli EPD era facoltativo con il risultato finale di un basso utilizzo di questi devices che a loro volta richiedono una curva di apprendimento. Nel CREST, al contrario, tutti gli operatori erano esperti e l’uso degli EPD era consilgiato per cui sono stati utilizzati in circa il 70% dei pazienti.
Considerando i bias sopra elencati, nell’EVA 3S, la CEA si associò ad una minore incidenza di stroke e morte tanto che lo studio fu interrotto precocemente. E’ importante sottolineare che la maggioranza degli stroke e delle morti in questo trial furono osservati in pazienti in cui non erano stati utilizzati EPD. Nello SPACE non furono osservate alcune differenze significative tra CAS e CEA nell’incidenza di stroke e morte a 30 giorni e tale risultato è rimasto invariato a due anni di follow up. Infine anche nell’ICCS non furono osservate differenze nell’end point primario (stroke disabilitante e morte) ma sono una differenza a favore della CEA nell’incidenza di stroke minori. In questo trial, oltre a consentire ad operatori poco esperti di partecipare nel braccio CAS, fu consentito di arruolare pazienti in cui erano stati impiantati stent da operatori sotto tutoraggio. Infatti, non può considerarsi un caso, se due centri poco esperti, hanno trattato solo 11 pazienti ed hanno prodotto 5 dei 17 stroke maggiori nel braccio CAS.
Il CREST, ha arruolato 2.502 pazienti sia sintomatici che asintomatici ed ha avuto la novità di un end point composto da stroke, morte ed infarto del miocardio. Non sono state osservate differenze nell’incidenza dell’end point primario fra CAS e CEA fino a quattro anni di follow up.
Il CAS si è associato ad un significativo aumento degli stroke minori mentre la CEA ad un aumento degli infarti del miocardio. E’ importante sottolineare che la mortalità dei pazienti era più alta fra quelli che erano colpiti da infarto periprocedurale nella CEA rispetto a quelli colpiti da stroke minore nel gruppo CAS.
Infine, non è di secondaria importanza notare come nel CREST ma anche in tutti gli altri trials di confronto, nella CEA vi sia una incidenza molto più alta di paralisi dei nervi cranici rispetto al CAS.
CONCLUSIONI
Il ruolo della rivascolarizzazione carotidea (CAS o CEA) continua ad essere oggetto di dibattito soprattutto per quanto riguarda i pazienti asintomatici con stenosi non critiche. In effetti, in questi pazienti non esistono dati relativi ad un confronto tra la rivascolarizzazione e la terapia medica ottimale “moderna” (aspirina, clopidogrel, statine, ACEI).
Le evidenze attuali suggeriscono che nei pazienti ad alto rischio chirurgico, candidati alla rivascolarizzazione il CAS è il trattamento di scelta (26)
Nei pazienti non ad alto rischio chirurgico, i dati della letteratura suggeriscono che con operatori esperti e con l’utilizzo degli EPD, il CAS e la CEA ssostanzialmente si equivalgono per cui la scelta sul trattamento in questi pazienti deve essere basata su un confronto che tenga conto delle preferenze del paziente e di caratteristiche cliniche o anatomiche che possono far scegliere l’una o l’altra delle metodiche di rivascolarizzazione (26).
Bibliografia
1. Lloyd-Jones D, Adams RJ, Brown TM, et al. Heart disease and stroke statistics—2010 update: a report from the American Heart Association. Circulation 2010;121:e46 –215..
2. Goldstein LB, Adams R, Alberts MJ, et al. Primary prevention of ischemic stroke: a guideline from the American Heart Association/ American Stroke Association Stroke Council: cosponsored by the Atherosclerotic Peripheral Vascular Disease Interdisciplinary Working Group; Cardiovascular Nursing Council; Clinical Cardiology Council; Nutrition, Physical Activity, and Metabolism Council; and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation 2006;113:e873–923.
3. Inzitari D, Eliasziw M, Gates P, et al. The causes and risk of stroke in patients with asymptomatic internal-carotid-artery stenosis. N Engl J Med 2000;342:1693–701.
4. Nicolaides AN, Kakkos SK, Griffin M, et al. Severity of asymptomatic carotid stenosis and risk of ipsilateral hemispheric ischaemic events: results from the ACSRS study. Eur J Vasc Endovasc Surg 2005;30: 275–84
5. Thacker EL, Wiggins KL, Rice KM, et al. Short-term and long-term risk of incident ischemic stroke after transient ischemic attack. Stroke;41:239–43.
6. Kleindorfer D, Panagos P, Pancioli A, et al. Incidence and short-term prognosis of transient ischemic attack in a population-based study. Stroke 2005;36:720 –3.
7. Hobson RW II, Weiss DG, Fields WS, et al., The Veterans AffairsCooperative Study Group. Efficacy of carotid endarterectomy for asymptomatic carotid stenosis. N Engl J Med 1993;328:221–7.
8. Executive Committee for the Asymptomatic Carotid Atherosclerosis Study (ACAS). Endarterectomy for asymptomatic carotid artery stenosis. JAMA 1995;273:1421– 8.
9. Halliday A, Mansfield A, Marro J, et al. Prevention of disabling andfatal strokes by successful carotid endarterectomy in patients without recent neurological symptoms: randomised controlled trial. Lancet2004;363:1491–502
10. Biller J, Feinberg WM, Castaldo JE, et al. Guidelines for carotid endarterectomy: a statement for healthcare professionals from a specialwriting group of the Stroke Council, American Heart Association. Stroke 1998;29:554–62.
11. Sacco RL, Adams R, Albers G, et al. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack: astatement for healthcare professionals from the American Heart Association/American Stroke Association Council on Stroke: co-sponsoredby the Council on Cardiovascular Radiology and Intervention: the American Academy of Neurology affirms the value of this guideline. Stroke 2006;37:577– 617.
12. Henry M, Henry I, Polydorou A, Hugel M. Carotid angioplasty and stenting in octogenarians: is it safe? Catheter Cardiovasc Interv 2008;72:309 –17.
13. Chiam P, Roubin G, Iyer S, et al. Carotid artery stenting in elderly patients: importance of case selection. Catheter Cardiovasc Interv 2008;72:318 –24.
14. Velez CA, White CJ, Reilly JP, et al. Carotid artery stent placement is safe in the very elderly (_ or _80 years). Catheter Cardiovasc Interv 2008;72:303– 8.
15. Grant A, White C, Ansel G, Bacharach M, Metzger C, Velez C. Safety and efficacy of carotid stenting in the very elderly. Catheter Cardiovasc Interv 2010;7:651–5.
16. Vogel TR, Dombrovskiy VY, Graham AM. Carotid artery stenting in the nation: the influence of hospital and physician volume on outcomes. Vasc Endovascular Surg 2010;44:89 –94.
17. Fiehler J, Jansen O, Berger J, Eckstein HH, Ringleb PA, Stingele R. Differences in complication rates among the centres in the SPACE study. Neuroradiology 2008;50:1049 –53.
18. Theiss W, Hermanek P, Mathias K, et al. Predictors of death and stroke after carotid angioplasty and stenting: a subgroup analysis of the Pro-CAS data. Stroke 2008;39:2325–30.
19. Mas JL, Chatellier G, Beyssen B, et al. Endarterectomy versus stenting in patients with symptomatic severe carotid stenosis. N Engl J Med 2006;355:1660 –71.
20. Ringleb PA, Allenberg J, Bruckmann H, et al. 30 day results from the SPACE trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomised non-inferiority trial. Lancet 2006;368:1239–47.
21. International Carotid Stenting Study Investigators. Carotid artery stenting compared with endarterectomy in patients with symptomatic carotid stenosis (International Carotid Stenting Study): an interim analysis of a randomised controlled trial. Lancet 2010;375:985–97.
22. Yadav JS, Wholey MH, Kuntz RE, et al. Protected carotid-artery stenting versus endarterectomy in high-risk patients. N Engl J Med 2004;351:1493–501.
23. Garg N, Karagiorgos N, Pisimisis GT, et al. Cerebral protection devices reduce periprocedural strokes during carotid angioplasty and stenting: a systematic review of the current literature. J Endovasc Ther 2009;16:412–27.
24. Gray WA, Chaturvedi S, Verta P. Thirty-day outcomes for carotid artery stenting in 6320 patients from 2 prospective, multicenter, high-surgical-risk registries. Circ Cardiovasc Interv 2009;2:159–66
25. Brott TG, Hobson RW 2nd, Howard G, Roubin GS, Clark WM, Brooks W, Mackey A, Hill MD, Leimgruber PP, Sheffet AJ, Howard VJ, Moore WS, Voeks JH, Hopkins LN, Cutlip DE, Cohen DJ, Popma JJ, Ferguson RD, Cohen SN, Blackshear JL, Silver FL, Mohr JP, Lal BK, Meschia JF; CREST Investigators Stenting versus endarterectomy for treatment of carotid-artery stenosis. N Engl J Med. 2010 Jul 1;363(1):11-23.
26. 2011ASA/ACCF/AHA/AANN/AANS/ACR/ASNR/CNS/SAIP/SCAI/SIR/SNIS/SVM/SVS Guideline on the Management of Patients With Extracranial Carotid and Vertebral Artery Disease A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, and the American Stroke Association, American Association of Neuroscience Nurses, American Association of Neurological Surgeons, American College of Radiology, American Society of Neuroradiology, Congress of Neurological Surgeons, Society of Atherosclerosis Imaging and Prevention, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of NeuroInterventional Surgery, Society for Vascular Medicine, and Society for Vascular Surgery. JACC Vol. 57, No. 8, 2011