|
LA EMBOLIA POLMONARE: COME PREVENIRLA, QUANDO SOSPETTARLA, COME TRATTARLA
Sergio Severino, Luigi Nunziata*, Sara Hana Weisz*, Sergio Padula, Ilaria Caso**, Roberta Ancona***, Salvatore Comenale Pinto, Raffaele Calabrò*, Pio Caso U.O.S.D Diagnostica non invasiva Cardiovascolare – U.O.C. Cardiologia – A.O. Monaldi (NA) *Cattedra di Cardiologia Seconda Università degli Studi di Napoli – A.O. Monaldi (NA) **U.O. Cardiologia - Ospedale S. Luca di Vallo della Lucania (SA) ***U.O. Cardiologia - Ospedale di Lagonegro (PZ)
L’embolia polmonare acuta è un’emergenza cardiovascolare abbastanza comune, che si manifesta a seguito dell’improvvisa chiusura dell’arteria polmonare o di uno dei suoi rami principali o secondari. L’estensione del letto vascolare compromesso influenza l’entità della sintomatologia e l’evoluzione clinica, che dipendono fondamentalmente dal grado di interessamento emodinamico del ventricolo destro. L’embolia polmonare rimane ancora una patologia ad elevata morbilità, in quanto la sua diagnosi rimane misconosciuta e non si accompagna ad una sintomatologia specifica. L’occlusione del lume vascolare polmonare è nella maggior parte dei casi dovuto ad un trombo-embolo, ma per completezza è necessario ricordare le più rare embolie da aria e grasso (che non verranno trattate in questo contesto).
FISIOPATOLOGIA Nella maggior parte dei pazienti, l’origine dell’embolo è un trombo presente a livello del sistema venoso profondo degli art inferiori che si estende fino alle vene poplitee, femorali o iliache, ma che parte solitamente da distretti venosi più periferici. L’ostruzione acuta del lume vascolare polmonare determina un improvviso aumento della pressione a monte, che si ripercuote molto rapidamente sul ventricolo destro. Tale incremento pressorio non è spiegato esclusivamente dalla grandezza dell’embolo, ma anche dalla vasocostrizione che si determina in conseguenza alla risposta infiammatoria locale 1. Quest’ultima è responsabile di modifiche locali del surfactant, zone di atelettasia e shunt artero-venosi che sono anche i responsabili dell’alterato scambio gassoso, caratteristico dell’embolia polmonare. La distensione improvvisa del ventricolo destro determina l’attivazione del meccanismo di Frank Starling, che associato all’effetto cronotropo ed inotropo positivo del sistema simpatico, riesce in alcuni dei pazienti a mantenere una discreta gittata cardiaca ed un buon flusso polmonare e periferico. Questo è importante in quanto da essi dipende la perfusione del circolo coronarico e di conseguenza anche la capacità contrattile del ventricolo destro. Se i meccanismi di compenso riescono a garantire un’adeguata contrazione del ventricolo destro nell’immediato, le successive 24-48 ore dall’evento sono ancora delicate per il paziente. Infatti in questa fase possono occorrere nuove embolie (soprattutto nel paziente in cui l’embolia polmonare non è stata ancora diagnosticata e quindi trattata) oppure vi può essere un decadimento della funzione ventricolare destra per progressiva discrepanza tra richiesta di ossigeno e flusso coronarico (per la bassa pressione in aorta).
CLASSIFICAZIONE L’embolia polmonare può essere distinta in massima o submassiva:
1. l’embolia polmonare è detta massiva quando determina ipotensione (PAS < 90 mmHg) o caduta della pressione arteriosa sistolica > 40 mmHg e deve essere sospettata ogni qualvolta un paziente presenta ipotensione con aumento della pressione venosa centrale e in assenza di altre cause che possano spiegarlo 2 (tamponamento, pneumotorace iperteso, infarto acuto del miocardio). 2. l’embolia polmonare è, invece, submassiva tutte le volte che non rientra nei criteri della forma massiva.
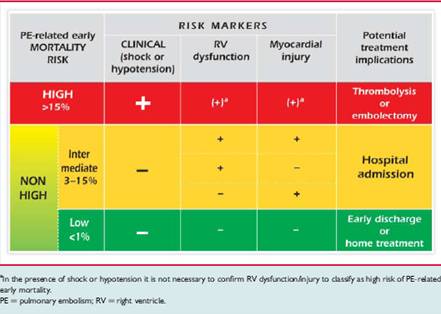
PROGNOSI La prognosi dei pazienti con embolia polmonare si giova moltissimo della terapia anticoagulante, in quanto rispetto ai pazienti non trattati, in cui la mortalità può ragguingere circa il 30%, nei pazienti trattati con anticoagulanti la mortalità scende al 2-8% 3-4-5-6. Il primo importante fattore condizionante la prognosi è la funzione ventricolare destra. E’ stato visto infatti che nei pazienti con embolia polmonare, sia ipotesi che normotesi, la disfunzione ventricolare destra è associata ad aumento della mortalità 7. Inoltre, essa è associata ad un maggior rischio di sviluppare un nuovo episodio di embolia polmonare, di trombosi venosa profonda o una morte per embolia polmonare, soprattutto se è presente anche alla dimissione del paziente 8. Inoltre, anche la presenza di un trombo nel ventricolo destro è stata associata ad un peggiore outcome per il paziente 9. Il peptide natriuretico BNP è stato anch’esso studiato nell’embolia polmonare. L’aumento dei suoi valori nel sangue permette di individuare pazienti con un outcome peggiore, sia per l’aumento della mortalità che delle complicanze cliniche durante il ricovero (necessità di ventilazione meccanica, di trombolisi,…). Valori elevati, inoltre, predicono la comparsa di disfunzione ventricolare destra, che di per sé rappresenta un fattore prognostico negativo 10. Anche l’aumento della troponina, marker di morte miocardica, è indicativo di una peggiore prognosi per il paziente perché associato ad aumento della mortalità 11 e la valutazione combinata di troponina e BNP si è dimostrata anche superiore alla sola troponina nel predirla 12. Le Linee Guida dell’European Society of Cardiology del 2008 sull’embolia polmonare propongono uno schema di stratificazione del rischio del paziente che si basa sui marker prognostici di mortalità precoce (in ospedale o entro i 30 giorni) suddividendoli in markers clinici (shock o ipotensione), di disfunzione ventricolare destra e di danno miocardico 13. Tale approccio ha delle implicazioni sull’aggressività del management del paziente, dalle indagini diagnostiche alla terapia (Tabella I).
Tabella I Stratificazione del paziente con embolia polmonare acuta in base al rischio di mortalità precoce.
Ripresa da Torbicki A, Perrier A, Konstantinides S, et al. Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Eur Heart J. 2008 Sep;29(18):2276-315.
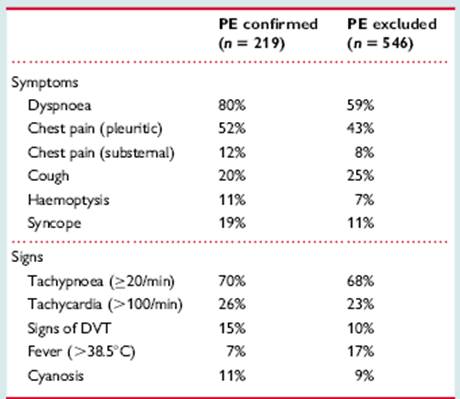
CLINICA Le manifestazioni cliniche dell’embolia polmonare sono del tutto simili ai segni e sintomi comunemente riscontrabili nel corso di altre patologie a carico dell’apparato cardiovascolare. Per questo motivo, per diagnosticare un’embolia polmonare è necessario sospettarne la presenza e ricercare quei segni e sintomi che da soli non riescono ad escludere o confermare la diagnosi, ma che sicuramente ne aumentano la probabilità. Nello Studio Prospective Investigation of Pulmonary Embolism Diagnosis (PIOPED II), i sintomi più frequentemente riscontrati nei pazienti con embolia polmonare esenti da pregresse patologie cardiovascolari sono stati la dispnea improvvisa (nel giro di pochi secondi o minuti) a riposo o sotto sforzo, il dolore pleuritico, la tosse ed i sibili respiratori. Tra i sintomi, invece, la tachicardia, la tachipnea, i rantoli, la riduzione del murmure vescicolare e l’accentuazione del II tono cardiaco. Comuni sono anche le manifestazioni locali, a livello della coscia o del polpaccio, legate alla trombosi venosa profonda: dolore, gonfiore, edema, eritema o la palpazione di una corda tesa 14. Utile è anche ricercare segni di DVT: trombosi venosa profonda., compromissione ventricolare destra, come il turgore Tabella II Prevalenza dei segni e sintomi in pazienti con sospetto di embolia polmonare, in base alla diagnosi finale.
Ripresa da Torbicki A, Perrier A, Konstantinides S, et al. Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Eur Heart J. 2008 Sep;29(18):2276-315.
delle giugulari o nei casi più gravi sincope, ipotensione o shock. Nelle Linee Guida dell’European Society del 2008, i segni ed i sintomi fondamentalmente coincidono fondamentalmente con quelli precedentemente elencati 13 (Tabella II), ma vengono aggiunti anche alcuni esami routinari dai quali si possono ottenere informazioni in più. Una radiografia del torace può essere utile per escludere altre cause di dispnea, un emogasanalisi può evidenziare ipossiemia con alterato gradiente alveolo-arterioso, un elettrocardiogramma può mostrare disturbi della conduzione e sovraccarico nelle derivazioni destre. Anche questi ultimi dati non sono esaustivi per porre la diagnosi, ma suggeriscono anch’essi di effettuare ulteriori approfondimenti.
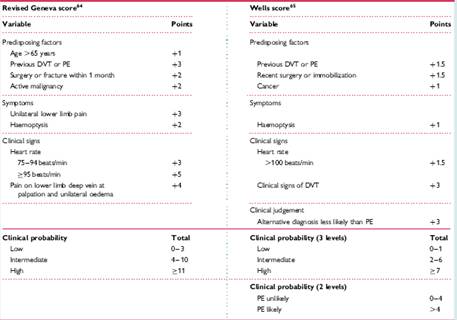
Tabella III Lo Score di Wells e lo Score di Geneva rivisitato.
Ripresa da Torbicki A, Perrier A, Konstantinides S, et al. Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Eur Heart J. 2008 Sep;29(18):2276-315.
La valutazione clinica del paziente con sospetto di embolia polmonare permette di porre il paziente in una categoria di probabilità mediante il giudizio clinico individuale del medico o mediante l’applicazione di score ben precisi, come lo Score di Wells 15 o lo Score di Geneva 13 (Tabella III).
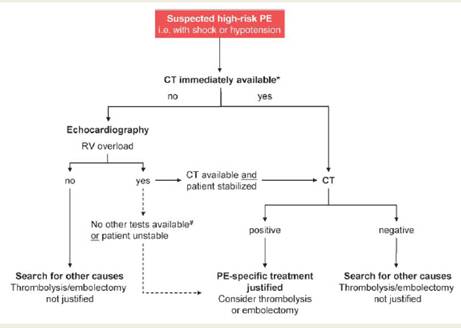
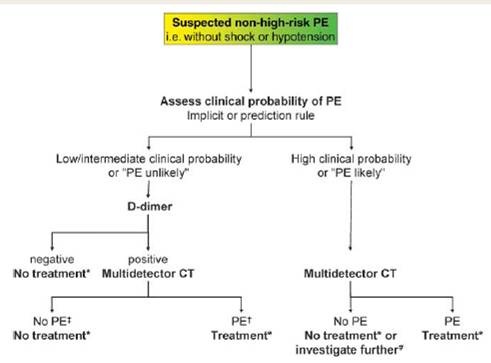
DIAGNOSI Le Linee Guida dell’European Society of Cardiology del 2008 13 propongono 2 schemi di indagini da eseguire, in base al quadro clinico di presentazione: - paziente ad alto rischio, con ipotensione o shock; - paziente non ad alto rischio, cioè senza ipotensione o shock. Nel paziente ad alto rischio, l’indagine iniziale più utile, anche per escludere eventuali altre diagnosi, è l’ecocardiografia. In realtà la metodica di prima scelta consigliata è l’angioTC, ma in questi pazienti essa è raramente effettuabile perché l’instabilità emodinamica non lo permette (Tabella IV). Nel paziente non ad alto rischio, invece, la valutazione clinica riveste un ruolo essenziale. Viene calcolato lo Score di probabilità di embolia polmonare (es. Tabella IV Algoritmo diagnostico per i pazienti con sospetta embolia polmonare ad alto rischio.
* La CT è considerara non disponibile anche quando le condizioni del paziente non permettono di effettuarla. # L’ecocardiografia transesofagea permette di evidenziare trombi nei rami dell’arteria polmonare; il CUS può evidenziare la trombosi venosa profonda. Ripresa da Torbicki A, Perrier A, Konstantinides S, et al. Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Eur Heart J. 2008 Sep;29(18):2276-315.
Score di Wells) e si distinguono i pazienti in quelli con embolia polmonare “non probabile” e “probabile”. Per quanto concerne il primo gruppo, se il D-dimero risulterà negativo, si potranno escludere ulteriori accertamenti, mentre se risulterà positivo, sarà necessario procedere con l’angioTC. Per i pazienti con embolia polmonare “probabile”, invece, è preferibile iniziare direttamente le indagini con un’angioTC (Tabella V).
D-dimero E’ il prodotto di degradazione della fibrina. Il suo dosaggio è consigliato nei pazienti non ad alto rischio, con bassa probabilità di embolia polmonare. Sono considerati anormali valori > 500 ng/mL se si utilizzano assay quantitativi 16. Il dosaggio del D-dimero è caratterizzato da una buona sensibilità e un buon valore predittivo negativo, mentre ha una bassa specificità e un basso valore predittivo positivo. Il suo dosaggio nei pazienti con alta probabilità clinica di embolia
Tabella V Algoritmo diagnostico per i pazienti con sospetta embolia polmonare non ad alto rischio.
Ripresa da Torbicki A, Perrier A, Konstantinides S, et al. Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Eur Heart J. 2008 Sep;29(18):2276-315.
polmonare non è consigliato perché in questi pazienti esso ha un basso valore predittivo negativo 17.
Scintigrafia ventilatoria e perfusiva Tale metodica è stata valutata nello Studio Prospective Investigation of Pulmonary Embolism Diagnosis (PIOPED) 18. Esso ha dimostrato l’elevata accuratezza diagnostica della scintigrafia quando essa viene abbinata ad una valutazione clinica del paziente. Una scintigrafia normale, inoltre, permette di escludere con buona possibilità un’embolia polmonare. E’ da dire, infine, che essa rappresenta una buona alternativa all’angioTC nei pazienti che presentano controindicazioni a tale esame.
Computed Tomography La TC permette di evidenziare nella maggioranza dei pazienti affetti la presenza di materiale embolico nel circolo polmonare 19. Uno dei suoi vantaggi consiste anche nella possibilità di mettere in evidenza altre anomalie polmonari che potrebbero spiegare il quadro clinico. L’accuratezza diagnostica della metodica, però, dipende molto dall’esperienza dell’operatore e varia da studio a studio, ma nonostante ciò si può quasi sempre escludere l’embolia polmonare in un paziente con TC negativa. Come per le altre metodiche, affinchè la TC possa essere un migliore strumento diagnostico per confermare o escludere l’embolia polmonare, è necessario associarla al calcolo della probabilità pretest e nei seppur rari casi di discordanza di risultati, è necessario procedere con ulteriori approfondimenti strumentali (es. angiografia polmonare).
Angiografia polmonare E’ il gold standard per l’evidenziazione dell’ostruzione dei rami polmonari. Essa non viene frequentemente eseguita perché essendo un esame invasivo, viene riservato ai rari casi in cui vi è una discordanza di risultati ai precedenti test non invasivi.
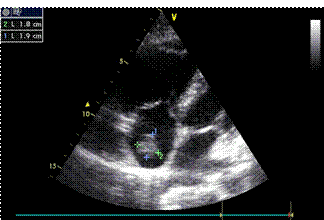
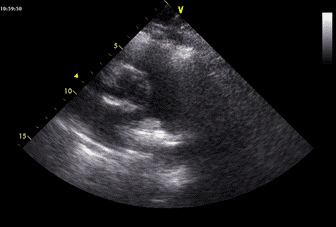
Ecocardiografia L’ecocardiografia riveste sicuramente un ruolo di primo piano nella valutazione del paziente ad alto rischio con ipotensione o shock. In questo contesto, infatti, l’assenza di segni di sovvraccarico e disfunzione ventricolare destra permettono l’esclusione dell’embolia polmonare. La dilatazione del ventricolo destro è presente in un quarto dei pazienti ed il suo riscontro ha un peso anche prognostico. Il Segno 60-60 ed il Segno di McConnell 20 sono indicativi di disfunzione ventricolare destra e, a differenza dell’insufficienza tricuspidale, sembrerebbero più rari nei pazienti con patologia respiratoria cronica 21. Il Segno di McConnell consiste nell’anomalia di contrazione della parete libera del ventricolo destro, con conservata cinesi dell’apice. Esso va inquadrato sempre nel contesto clinico, in quanto in un paziente con pregresso infarto del ventricolo destro, esso non assume lo stesso significato. Talvolta è possibile riscontrare un trombo in atrio destro (Fig.1) o nel tronco e nei rami polmonari prossimali (Fig.2). Nei pazienti non ad alto rischio, l’ecocardiografia non riveste un ruolo importante in quanto vengono preferite altre metodiche diagnostiche.
Fig.1 Trombo visibile in atrio destro
Fig.2 Trombo in arteria polmonare
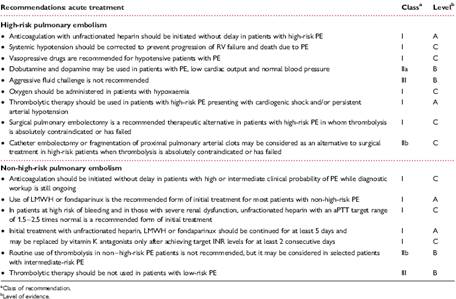
TERAPIA Anche la gestione terapeutica del paziente con sospetta embolia polmonare, risente della distinzione tra paziente ad alto rischio e non ad alto rischio. Bisogna comunque considerare che nei pazienti instabili, il primo presidio consiste nel dargli il supporto respiratorio (ossigeno, intubazione) ed emodinamico (fluidi, dopamina, adrenalina, noradrenalina), nonché iniziare una pronta terapia anticoagulante se il sospetto è forte. Essa non serve tanto a lisare il trombo già formato, ma a prevenire le recidive che nelle prime ore si associano ad alta mortalità. Nel paziente ad alto rischio, gli studi effettuati a riguardo sembrerebbero dimostrare la migliore prognosi nei pazienti che effettuano trombolisi 22. Per quanto concerne la terapia anticoagulante, invece, l’eparina non frazionata deve essere preferita. Nei pazienti non ad alto rischio, la trombolisi non dà nessun beneficio clinico 22 e, per quanto concerne la terapia anticoagulante, sono da preferire l’eparina a basso peso molecolare o il fondaparinux, somministrati in base
Tabella VI Raccomandazioni per il trattamento acuto dell’embolia polmonare acuta.
Ripresa da Torbicki A, Perrier A, Konstantinides S, et al. Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Eur Heart J. 2008 Sep;29(18):2276-315.
al peso corporeo. Una metodica alternativa alla trombolisi, utilizzata nei pazienti con aumentato rischio emorragico, è l’embolectomia percutanea o chirugica. La terapia anticoagulante a lungo termine è un problema non di poco conto per i pazienti con pregressa embolia polmonare acuta. Quando un fattore predisponente è evidenziabile o quando si tratta del primo episodio sine causa identificabile, le Linee Guida dell’European Society of cardiology raccomandano (Classe IA) di anticoagulare il paziente con antagonisti della vitamina K per i primi tre mesi (INR target 2-3). Se invece si tratta del secondo episodio sine causa apparente, la raccomandazione è per una terapia anticoagulante a vita (Classe IA) sempre con antagonisti della vitamina K 13. Nel caso in cui l’embolia polmonare avvenga in un paziente con patolgia tumorale, invece, è raccomandata una terapia con eparina a basso peso molecolare nei primi 3-6 mesi, quindi sarà possibile il passaggio agli antagonisti della vitamina K o continuare a vita con l’eparina a basso peso molecolare. I filtri in vena cava sono dei presidi che vengono posizionati qualora esiste una causa permanente non rimuovibile (es. trombo flottante in vena femorale).
BIBLIOGRAFIA
1. Nakos G, Kitsiouli EI, Lekka ME. Bronchoalveolar lavage alterations in pulmonary embolism. Am J Respir Crit Care Med 1998; 158:1504 2. Kucher N, Goldhaber SZ. Management of massive pulmonary embolism. Circulation 2005; 112:e28 3. Horlander, KT, Mannino, DM, Leeper, KV. Pulmonary embolism mortality in the United States, 1979-1998: an analysis using multiple-cause mortality data. Arch Intern Med 2003; 163:1711 4. Carson, JL, Kelley, MA, Duff, A, et al. The clinical course of pulmonary embolism: One year follow-up of PIOPED patients. N Engl J Med 1992; 326:1240 5. Goldhaber, SZ, Visani, L, De Rosa, M. Acute pulmonary embolism: Clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999; 353:1386 6. Nijkeuter, M, Sohne, M, Tick, LW, et al. The natural course of hemodynamically stable pulmonary embolism: Clinical outcome and risk factors in a large prospective cohort study. Chest 2007; 131:517 7. ten Wolde, M, Sohne, M, Quak, E, et al. Prognostic value of echocardiographically assessed right ventricular dysfunction in patients with pulmonary embolism. Arch Intern Med 2004; 164:1685 8. Grifoni, S, Vanni, S, Magazzini, S, et al. Association of persistent right ventricular dysfunction at hospital discharge after acute pulmonary embolism with recurrent thromboembolic events. Arch Intern Med 2006; 166:2151 9. Torbicki, A, Galie, N, Covezzoli, A, et al. Right heart thrombi in pulmonary embolism: results from the International Cooperative Pulmonary Embolism Registry. J Am Coll Cardiol 2003; 41:2245 10. Kucher, N, Printzen, G, Goldhaber, SZ. Prognostic role of brain natriuretic peptide in acute pulmonary embolism. Circulation 2003; 107:2545 11. Becattini, C, Vedovati, MC, Agnelli, G. Prognostic value of troponins in acute pulmonary embolism: a meta-analysis. Circulation 2007; 116:427 12. Kostrubiec, M, Pruszczyk, P, Bochowicz, A, et al. Biomarker-based risk assessment model in acute pulmonary embolism. Eur Heart J 2005; 26:2166 13. Torbicki A, Perrier A, Konstantinides S, et al. Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology. Eur Heart J. 2008 Sep;29(18):2276-315 14. Stein, PD, Beemath, A, Matta, F, et al. Clinical characteristics of patients with acute pulmonary embolism: data from PIOPED II. Am J Med 2007; 120:871 15. Wells, PS, Ginsberg, JS, Anderson, DR, et al. Use of a clinical model for safe management of patients with suspected pulmonary embolism. Ann Intern Med 1998; 129:997 16. Stein, PD, Hull, RD, Patel, KC, et al. D-dimer for the exclusion of acute venous thrombosis and pulmonary embolism: a systematic review. Ann Intern Med 2004; 140:589 17. Righini M, Aujesky D, Roy PM et al. Clinical usefulness of D-dimer depending on clinical probability and cutoff value in outpatients with suspected pulmonary embolism. Arch Intern Med 2004;164:2483-2487 18. Value of the ventilation/perfusion scan in acute pulmonary embolism. Results of the prospective investigation of pulmonary embolism diagnosis (PIOPED). The PIOPED Investigators. JAMA 1990; 263:2753 19. Kim, KI, Muller, NL, Mayo, JR. Clinically suspected pulmonary embolism: Utility of spiral CT. Radiology 1999; 210:693 20. McConnell, MV, Solomon, SD, Rayan, ME, et al. Regional right ventricular dysfunction detected by echocardiography in acute pulmonary embolism. Am J Cardiol 1996; 78:469 21. Kurzyna M, Torbicki A, Pruszczyk P et al. Disturbed right ventricukar ejection pattern as a new Doppler echocardiographic sign of acute pulmonary embolism. Am J Cardiol 2002;90:507-511 22. Wan S, Quinlan DJ, Agnelli G et al. Thrombolysis compared with heparin for the initial treatment of pulmonary embolism: a meta-analysis of the randomized controlled trials. Circulation 2004;110:744-749
|