|
Processo all’angioplastica multivaso: La Difesa. Tullio Niglio, MD, Carolina D’Anna, MD, Federico Piscione, MD. Laboratorio di Emodinamica e Cardiologia Interventistica. Dipartimento di Medicina Clinica, Scienze Cardiovascolari ed Immunologiche. Università degli Studi di Napoli “Federico II”
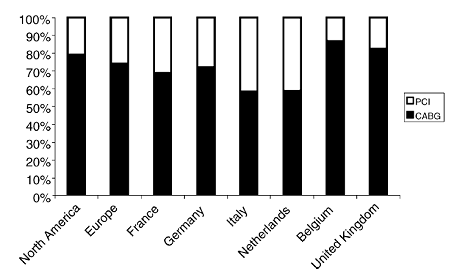
Affrontare la complessa questione sulle possibili strategie di rivascolarizzazione per i pazienti con malattia coronarica multi-vasale – intervento coronarico percutaneo (PCI) o chirurgico (CABG) – costituisce non solo un problema scientificamente attuale, ma anche di stretto interesse epidemiologico se si tiene conto che l’Italia, insieme all’Olanda, detiene il primato di rivascolarizzazione coronarica multi-vasale mediante PCI.1 In cifre, mentre nel Nord America solo il 20% dei pazienti con malattia dei tre vasi è rivascolarizzato attraverso PCI (lasciando il restante 80% dei casi alla chirurgia), in Italia il 40% circa di tali pazienti è trattato con PCI (figura 1). Figura 1. Tassi di rivascolarizzazione coronarica nei pazienti con malattia multi-vasale trattati con intervento coronarico percutaneo (PCI) e by pass aorto-coronarico (CABG).
Naturalmente, risulta impossibile discernere se tale dato sia da ascrivere ad un’impavida cardiologica interventistica, ad una prudente chirurgia cardiaca, ovvero alla maggior aderenza americana alle Linee-Guida. Quest’ultime, infatti, relegano la PCI, per i pazienti con malattia multivasale, ad indicazioni di Classe IIb oppure III, con bassi livelli di evidenza.2,3 Ne l corso di quest’anno, inoltre, sono stati pubblicati, per la prima volta, i criteri di appropriatezza per la rivascolarizzazione coronarica, che indicano, per i pazienti con malattia multi-vasale, come “appropriato” l’intervento di by-pass aortocoronarico, e conferiscono, invece, all’angioplastica un più che pusillanime “incerto”.4 Certamente, gli orientamenti terapeutici tracciati dalle Linee-Guida poggiano su basi scientifiche solide: infatti tutti gli studi che hanno messo a confronto PCI e CABG – sia con l’angioplastica col solo pallone (GABI, EAS, RITA, ERACI, CABRI e BARI), sia con l’utilizzo di stent non-medicati (MASS-2, SoS, ARTS I), che con quello di stent medicati (MAIN-COMPARE, LE MANS) – hanno evidenziato una maggior necessità di re-intervento nei pazienti trattati con angioplastica. Dunque, dal momento che già i singoli studi hanno dimostrato un beneficio della chirurgia in termini di re-intervento, le più recenti meta-analisi non sono altro che pleonastici coacervi di dati che ripropongono nuovamente risultati già noti alla comunità scientifica.5,6 In realtà, nel pesare le possibili alternative terapeutiche, non si può ciecamente limitare il perimetro delle variabili cliniche valutate semplicisticamente a quelle di pertinenza cardiovascolare (morte, infarto, ictus cerebri e nuova rivascolarizzazione). Non si possono ignorare complicanze, eufemisticamente “accessorie”, della chirurgia cardiaca: nello studio di Lu et al.7, per esempio, in cui sono stati arruolati pazienti candidati a CABG per malattia del tronco comune trattati sia in off- che on-pump, oltre ad una mortalità intra-ospedaliera del 2.8%, possono, altresì, essere menzionate l’insufficienza renale (≈ 3.8%), complicanze gastrointestinali (≈3.5%), aritmie atriali (≈30%) e ventricolari (≈3.4%), necessità di impiantare un pacemaker (≈3.5%), infezioni toraciche (≈5%), infezioni della ferita (≈4%), reintervento per emorragia (≈3%), ventilazione >48 ore (≈5.5%), degenza post-operatoria >14 giorni (≈9%). Ed ancora, la disfunzione cognitiva post-operatoria, coinvolgente funzioni quali la memoria, la capacità di concentrarsi o di processare correttamente le informazioni, è una complicanza nota da più di 30 anni.8 La disfunzione cognitiva post-operatoria non risparmia neppure l’acclamata chirurgia off-pump: in uno studio randomizzato del 2002, il 21% dei pazienti trattati in “off-pump” ed il 29% di quelli trattati in “on-pump” hanno sviluppato un declino cognitivo a 3 mesi dopo la chirurgia cardiaca (differenza statisticamente non significativa, p=0.15).9 Un altro problema, che potrebbe apparire ai più semplice logomachia, è rappresentato dal processo diagnostico che conduce alla definizione di malattia multi-vasale. Per esempio, in uno studio, che ha coinvolto 250 pazienti (471 lesioni coronariche), sono state messe a confronto due strategie diagnostiche: una costituita solo dall’angiografia coronarica e l’altra guidata anche dalla valutazione della riserva di flusso coronarico, al fine di definire non solo le caratteristiche anatomiche dei vasi coronarici, ma anche quelle funzionali.10 Dunque, mentre con la sola valutazione angiografica il 30%, 43% e 27% dei pazienti è stato definito affetto da malattia coronarica, rispettivamente, mono-, bi- e tri-vasale; con la seconda strategia, il 60%, 17% e 9% degli pazienti è stato classificato affetto da malattia coronarica mono-, bi- e tri-vasale.10 Sono, pertanto, almeno tre gli elementi degni di nota: il primo, con la sola valutazione angiografica nel 58% dei casi si commette un errore di classificazione; il secondo, il 14% dei pazienti cui è stata diagnosticata una malattia coronarica mono-vasale, in realtà, non ha una stenosi significativa dal punto di vista funzionale; il terzo, 2 pazienti su 3, definiti angiograficamente tri-vasali, sono funzionalmente bi-vasali, o, addirittura, mono-vasali. Risulta, pertanto, evidente la complessità e l’eterogeneità dei pazienti con malattia multi-vasale, il giogo imposto dalla sola definizione angiografica, e come un problema inizialmente a carattere semantico trasli in un piano a contenuto epistemologico. Sono proprio questi i motivi per cui recentemente è stato sviluppato il SYNTAX score11: esso si basa sulla valutazione di singole lesioni coronariche (che vanno tra loro sommate per ottenere uno score totale), tenendo conto della localizzazione lungo il decorso epicardico, la dominanza del vaso, il grado di stenosi, la presenza di lesioni di biforcazione o triforcazione, la tortuosità della coronaria interessata, la lunghezza della lesione stessa, la presenza di trombosi intraluminale, la localizzazione aorto-ostiale e l’estrema calcificazione. Questo score è stato poi applicato ai pazienti arruolati nello studio SYNTAX12, che ha messo a confronto CABG versus PCI con impianto di stent medicato (nel trial è stato utilizzato il dispositivo TAXUS, a rilascio di paclitaxel, che è in grado, interferendo con la funzione linfocitaria, di inibire il ciclo cellulare, e la proliferazione neo-intimale, responsabile, infine, della restenosi dello stent e della necessità di nuova rivascolarizzazione). Nel SYNTAX sono stati arruolati 1,800 pazienti, con malattia tri-vasale e/o malattia del tronco comune, e randomizzati, in proporzione 1:1, a CABG o PCI con impianto di TAXUS.12 I risultati ad 1 anno, hanno mostrato un vantaggio della chirurgia in termini di nuova rivascolarizzazione (13.5% vs. 5.9%, PCI vs CABG rispettivamente), mentre l’incidenza di morte ed infarto del miocardio è sovrapponibile tra le due strategie. In aggiunta, l’ictus, complicanza che è associata ad un’elevata incidenza di grave disabilità permanente, è risultato più frequente nei pazienti trattati con CABG (2.2% vs. 0.6% rispettivamente). Se da una parte, coloro che difendono la chirurgia correlano la più alta incidenza di ictus ad un basso rate di interventi eseguiti off-pump (15%), dall’altra parte, essendo il SYNTAX un trial multi-centrico, in cui ben 85 centri distribuiti in 17 nazioni sono stati coinvolti, il 15% degli interventi off-pump riflette in maniera reale la corrente pratica chirurgica dell’Europa e degli Stati Uniti. Fino a quanto detto, sembrerebbe che il SYNTAX abbia aggiunto poco alle conoscenze già acquisite su questo tema. In realtà, la parte più interessante dello studio è l’analisi effettuata in base alla severità delle lesioni da rivascolarizzare, sulla scorta del SYNTAX score. Infatti, dividendo la popolazione in base ad uno score basso (≤22), intermedio (23-32) ed alto (≥33), si osserva che non vi è differenza tra CABG e PCI per i pazienti a score basso ed intermedio, mentre il vantaggio è chiaramente a favore della chirurgia per i pazienti con uno score alto. Anche i risultati a 2 anni, presentati recentemente al congresso della Società Europea di Cardiologia (ESC), mostrano un trend simile: non vi è differenza tra CABG e PCI per i pazienti con un SYNTAX score basso ed intermedio. Il messaggio che ne deriva risulta chiaro: prima di affidare al chirurgo un paziente con malattia multivasale, bisognerebbe stadiare la severità della malattia coronarica, così come da decenni l’oncologia fa per le patologie neoplastiche, valutare il rischio chirurgico del paziente stesso, discutere il caso col cardiochirurgo e, solo a questo punto, intraprendere una decisione finale, tenendo conto della sovrapponibilità dei risultati tra chirurgia ed angioplastica in casi selezionati. Nel SYNTAX, ad esempio, il tempo tra l’angiografia coronarica e l’angioplastica è stato in media di circa 7 giorni, a riprova della necessaria interrelazione tra cardiologo interventista e cardiochirurgo. Se lo studio SYNTAX ha proposto un nuovo modo di guardare alla malattia coronarica multi-vasale, “there is three-vessel disease and three-vessel disease” dice P.W. Serruys, fornendo uno strumento in grado di discernere forme complesse di malattia coronarica, da forme a grado basso o intermedio, lo studio FAME13, anche esso di recente pubblicazione, propone un’ulteriore prospettiva: basare l’individuazione del paziente multi-vasale non già sulle sole basi anatomiche, ma funzionali. Lo studio ha randomizzato 1,005 pazienti con malattia multi-vasale (definita come una stenosi >50% in almeno 2 delle 3 coronarie epicardiche maggiori) a ricevere una rivascolarizzazione mediante PCI e guidata solo dall’angiografia, o una rivascolarizzazione mediante PCI e misurazione, in tutte le lesioni >50%, della riserva di flusso coronarico (FFR), un indice accurato per indicare se una particolare stenosi coronarica sia responsabile di ischemia inducibile. Nei pazienti randomizzati a quest’ultimo braccio, l’angioplastica è stata eseguita solo in caso di ridotta FFR (rapporto tra pressione media distale e prossimale alla stenosi <0.8014). I risultati ad un anno hanno dimostrato una riduzione, a favore della misurazione di routine della FFR, dell’endpoint composito di morte, infarto del miocardio e necessità di re-intervento di circa il 30%, guidata essenzialmente da una ridotta incidenza del composito di morte ed infarto del miocardio. Inoltre, l’elemento più suggestivo dello studio è che gli eventi maggiori cardio-cerebro-vascolari nel braccio FFR del FAME (11%) sono del tutto sovrapponibili al braccio CABG del SYNTAX (12.4%). I risultati del SYNTAX e del FAME gettano nuova luce sulla rivascolarizzazione del paziente con malattia coronarica multi-vasale, ponendo le basi per un nuovo rinascimento dell’approccio percutaneo in questo specifico scenario clinico e delineando in maniera definitiva il crepuscolo della stentomania.
Bibliografia
1. Kappetein AP, Dawkins KD, Mohr FW, Morice MC, Mack MJ, Russell ME, Pomar J, Serruys PW. Current percutaneous coronary intervention and coronary artery bypass grafting practices for three-vessel and left main coronary artery disease. Insights from the SYNTAX run-in phase. Eur J Cardiothorac Surg. 2006 Apr;29(4):486-91. 2. Smith SC Jr, Feldman TE, Hirshfeld JW Jr, Jacobs AK, Kern MJ, King SB 3rd, Morrison DA, O'Neil WW, Schaff HV, Whitlow PL, Williams DO, Antman EM, Adams CD, Anderson JL, Faxon DP, Fuster V, Halperin JL, Hiratzka LF, Hunt SA, Nishimura R, Ornato JP, Page RL, Riegel B; American College of Cardiology/American Heart Association Task Force on Practice Guidelines; ACC/AHA/SCAI Writing Committee to Update 2001 Guidelines for Percutaneous Coronary Intervention. ACC/AHA/SCAI 2005 guideline update for percutaneous coronary intervention: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/SCAI Writing Committee to Update 2001 Guidelines for Percutaneous Coronary Intervention). Circulation. 2006 Feb 21;113(7):e166-286. 3. Silber S, Albertsson P, Avilés FF, Camici PG, Colombo A, Hamm C, Jørgensen E, Marco J, Nordrehaug JE, Ruzyllo W, Urban P, Stone GW, Wijns W; Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology. Guidelines for percutaneous coronary interventions. The Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology. Eur Heart J. 2005 Apr;26(8):804-47. 4. Patel MR, Dehmer GJ, Hirshfeld JW, Smith PK, Spertus JA; American College of Cardiology Foundation Appropriateness Criteria Task Force; Society for Cardiovascular Angiography and Interventions; Society of Thoracic Surgeons; American Association for Thoracic Surgery; American Heart Association, and the American Society of Nuclear Cardiology Endorsed by the American Society of Echocardiography; Heart Failure Society of America; Society of Cardiovascular Computed Tomography. ACCF/SCAI/STS/AATS/AHA/ASNC 2009 Appropriateness Criteria for Coronary Revascularization: a report by the American College of Cardiology Foundation Appropriateness Criteria Task Force, Society for Cardiovascular Angiography and Interventions, Society of Thoracic Surgeons, American Association for Thoracic Surgery, American Heart Association, and the American Society of Nuclear Cardiology Endorsed by the American Society of Echocardiography, the Heart Failure Society of America, and the Society of Cardiovascular Computed Tomography. J Am Coll Cardiol. 2009 Feb 10;53(6):530-53. 5. Daemen J, Boersma E, Flather M, Booth J, Stables R, Rodriguez A, Rodriguez-Granillo G, Hueb WA, Lemos PA, Serruys PW. Long-term safety and efficacy of percutaneous coronary intervention with stenting and coronary artery bypass surgery for multivessel coronary artery disease: a meta-analysis with 5-year patient-level data from the ARTS, ERACI-II, MASS-II, and SoS trials. Circulation. 2008 Sep 9;118(11):1146-54. 6. Hlatky MA, Boothroyd DB, Bravata DM, Boersma E, Booth J, Brooks MM, Carrié D, Clayton TC, Danchin N, Flather M, Hamm CW, Hueb WA, Kähler J, Kelsey SF, King SB, Kosinski AS, Lopes N, McDonald KM, Rodriguez A, Serruys P, Sigwart U, Stables RH, Owens DK, Pocock SJ. Coronary artery bypass surgery compared with percutaneous coronary interventions for multivessel disease: a collaborative analysis of individual patient data from ten randomised trials. Lancet. 2009 Apr 4;373(9670):1190-7. 7. Lu JC, Grayson AD, Pullan DM. On-pump versus off-pump surgical revascularization for left main stem stenosis: risk adjusted outcomes. Ann Thorac Surg. 2005 Jul;80(1):136-42. 8. Funder KS, Steinmetz J, Rasmussen LS. Cognitive dysfunction after cardiovascular surgery. Minerva Anestesiol. 2009 May;75(5):329-32. 9. Van Dijk D, Jansen EW, Hijman R, Nierich AP, Diephuis JC, Moons KG, Lahpor JR, Borst C, Keizer AM, Nathoe HM, Grobbee DE, De Jaegere PP, Kalkman CJ; Octopus Study Group. Cognitive outcome after off-pump and on-pump coronary artery bypass graft surgery: a randomized trial. JAMA. 2002 Mar 20;287(11):1405-12. 10. Sant'Anna FM, Silva EE, Batista LA, Ventura FM, Barrozo CA, Pijls NH. Influence of routine assessment of fractional flow reserve on decision making during coronary interventions. Am J Cardiol. 2007 Feb 15;99(4):504-8. 11. Sianos G, Morel MA, Kappetein AP, Morice MC, Colombo A, Dawkins K, van den Brand M, Van Dyck N, Russell ME, Mohr FW, Serruys PW. The SYNTAX Score: an angiographic tool grading the complexity of coronary artery disease. EuroIntervention. 2005 Aug;1(2):219-27. 12. Serruys PW, Morice MC, Kappetein AP, Colombo A, Holmes DR, Mack MJ, Ståhle E, Feldman TE, van den Brand M, Bass EJ, Van Dyck N, Leadley K, Dawkins KD, Mohr FW; SYNTAX Investigators. Percutaneous coronary intervention versus coronary-artery bypass grafting for severe coronary artery disease. N Engl J Med. 2009 Mar 5;360(10):961-72. 13. Tonino PA, De Bruyne B, Pijls NH, Siebert U, Ikeno F, van' t Veer M, Klauss V, Manoharan G, Engstrøm T, Oldroyd KG, Ver Lee PN, MacCarthy PA, Fearon WF; FAME Study Investigators. Fractional flow reserve versus angiography for guiding percutaneous coronary intervention. N Engl J Med. 2009 Jan 15;360(3):213-24. 14. De Rosa R, Piccolo R, Cassese S, Petretta A, D’Andrea C, D’Anna C, Piscione F, Chiariello M. Coronary Flow Reserve evaluation: basics, techniques and clinical application. Minerva Cardioangiologica – in press.
|