
|
LA TERAPIA CHIRURGICA DELLA DISSEZIONE AORTICA
Antonio Longobardi, Antonio Panza, Paolo Masiello, Severino Iesu, Giuseppe Di BenedettoO. Struttura Complessa di Cardiochirurgia, Dipartimento “Cuore”, Azienda Ospedaliera Universitaria Ospedali Riuniti San Giovanni di Dio e Ruggi D’Aragona (Salerno).
INTRODUZIONE Con il termine di “sindrome aortica acuta” s’intende una lesione acuta della parete aortica accompagnata dall’indebolimento della tunica media che aumenta il rischio di rottura o di altre complicanze, ed è accompagnata ad un’elevata morbidità e mortalità. Comprende diverse componenti: dissezione aortica, ematoma/emorragia intramurale ed ulcera penetrante [1]. Recenti studi hanno dimostrato che l’emorragia intramurale, l’ematoma intramurale ed ulcera aortica possono essere considerati diversi sottotipi di dissezione aortica oppure rappresentare momenti evolutivi di una stessa dissezione. Per questo motivo è stata proposta tale classificazione: classe 1: dissezione aortica “classica” con flap intimale tra vero e falso lume; classe 2: ematoma/emorragia intramurale localizzate nella media, senza breccia intimale; classe 3: dissezione aortica “subdola” o “discreta” (clinicamente poco manifesta) definita da una localizzata espansione a livello della breccia intimale; classe 4: ulcera penetrante caratterizzata dalla rottura di una placca con formazione di un ematoma generalmente sottoavventiziale; classe 5: dissezione iatrogena o traumatica (figura 1) [2]. L’incidenza di sindrome aortica acuta varia da 2,6 a 3,5 casi ogni 100.000 abitanti per anno, rappresentando lo 0,3% dei pazienti che si recano al pronto soccorso per dolore toracico. Nel 40% dei casi si tratta di dissezione aortica vera e propria, nel 25% di ematoma intramurale e nel 35% viene identificata un’ulcera penetrante [3]. 
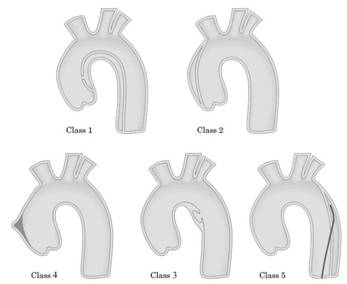
Patogenesi La dissezione aortica “classica” (classe 1) risulta da una lacerazione intimale che permette il passaggio di sangue all’interno della media (tra i 2/3 interni e 1/3 esterno) creando un “falso lume”. Questo canale è delimitato all’esterno solo da uno strato della media e dall’avventizia e, per tale motivo, è molto fragile. Ad ogni contrazione cardiaca il canale di dissezione si può estendere prossimalmente o distalmente dando origine a diverse possibili complicanze: emopericardio con conseguente tamponamento cardiaco (rappresenta la causa più frequente di morte), rottura intrapleurica, insufficienza aortica, infarto miocardico. Inoltre è possibile l’estensione della dissezione ai tronchi sovraortici causando stroke ed ischemia alle estremità superiori del corpo, ai vasi intercostali con conseguente paraplegia, ai vasi mesenterici ed alle arterie renali provocando ischemia intestinale e renale, ai vasi ilio-femorali con ischemia agli arti inferiori [4]. La necessità di correlare la fisiopatologia con l’approccio diagnostico-terapeutico ha portato diversi cardiochirurghi a proporre delle classificazioni che esprimessero immediatamente lo stato anatomo-clinico della patologia. Esse si basano essenzialmente sulla definizione del sito della lesione intimale, dell’estensione del processo dissecante e del coinvolgimento dell’aorta ascendente. Le classificazioni più impiegate nella pratica clinica sono quella di DeBakey e quella di Stanford. Nel tipo I della classificazione di DeBakey la lacerazione intimale è localizzata a livello dell’aorta ascendente e la dissezione coinvolge l’aorta ascendente, l’arco, l’aorta toracica discendente ed addominale in maniera più o meno estesa; nel tipo II la dissezione è limitata all’aorta ascendente; nel tipo III la lacerazione intimale è localizzata a livello dell’aorta toracica discendente e la dissezione può essere confinata al tratto toracico dell’aorta discendente (tipo IIIa) oppure può estendersi all’aorta addominale con coinvolgimento o meno delle arterie iliache (tipo IIIb), inoltre la dissezione si può anche spingere prossimalmente interessando l’arco e l’aorta ascendente. Nel tipo A della classificazione di Stanford la lacerazione intimale è localizzata a livello dell’aorta ascendente, dell’arco o dell’aorta toracica discendente distalmente l’origine della succlavia, la rima di dissezione comprende l’aorta ascendente con interessamento o meno dell’arco e dell’aorta toracica discendente; nel tipo B la lacerazione intimale è localizzata a livello dell’aorta toracica discendente e la dissezione interessa l’aorta discendente; in questo tipo vengono comprese anche quelle dissezioni con estensione all’arco (dissezione retrograda) e quelle che originano a livello dell’arco e si estendono distalmente (anterograde), senza interessare l’aorta ascendente. La dissezione è definita acuta quando viene diagnosticata entro 14 giorni dall’esordio dei sintomi, altrimenti viene considerata cronica [5]. L’ematoma/emorragia intramurale (classe 2) deriva dalla rottura dei vasa vasorum con formazione di un versamento ematico circonferenziale nello spessore della media in assenza di iniziale lesione intimale. Probabilmente l’ematoma intramurale rappresenta la lesione primitiva nella maggior parte dei casi di dissezione dovuta a degenerazione cistica della media: con l’aumentare delle dimensioni dell’ematoma la parete interna indebolita è soggetta alle forze di contraccolpo diastolico che possono comportare una lacerazione intimale ed evoluzione in una classica dissezione aortica (28-47% dei casi) o in rottura aortica (21-47%); tuttavia è anche possibile che l’ematoma resti circoscritto e vada incontro a successiva regressione (10%). In caso di dissezione aortica “subdola” o “discreta” (classe 3) vi è una parziale lacerazione intimale ricoperta da un trombo che può andare incontro a cicatrizzazione e quindi a guarigione oppure permettere infiltrazione di sangue nella tunica media con conseguente dissezione vera e propria o rottura della parete vasale. L’ulcera penetrante (classe 4) è caratterizzata da una rottura della lamina elastica interna sottostante una placca ateromatosa con stravaso ematico nella media e formazione di un ematoma, di una dissezione localizzata o perforazione aortica. Un brusco trauma toracico può essere responsabile di dissezione dell’aorta ascendente o di quella in corrispondenza dell’istmo (regione del legamento di Botallo). La dissezione aortica iatrogena (classe 5), invece, può verificarsi in seguito a cateterismo cardiaco, a trattamento mediante angioplastica di una coartazione aortica (nell’adulto), a clampaggio aortico o a posizionamento di un contropulsatore aortico [2].
Tecnica chirurgica L’intervento chirurgico, in anestesia generale, prevede l’esecuzione di una sternotomia mediana longitudinale ed il bypass cardiopolmonare cannulando l’atrio destro (per il drenaggio venoso) e l’arteria femorale. Per evitare fenomeni di malperfusione è possibile utilizzare siti alternativi di cannulazione arteriosa, come l’arteria ascellare e la succlavia. La scelta dell’opzione chirurgica trae origine dalla situazione anatomica (sede della breccia intimale ed estensione del falso lume) e dalla capacità del chirurgo di fare quanto basta a salvare la vita del paziente, assicurandogli un periodo postoperatorio privo di complicanze a medio-lungo termine. Scopi della chirurgia sono la chiusura della breccia intimale primaria, l’eliminazione del falso lume a livello prossimale (maggiore incidenza di rottura), correzione di eventuali patologie cardiache presenti e/o determinate dalla dissezione (come l’insufficienza aortica o l’ischemia miocardica). In caso di breccia intimale localizzata a livello dell’aorta ascendente o dell’arco aortico, il tratto di aorta interessato viene sempre asportato, mentre in caso di localizzazione a livello dell’aorta toracica discendente non è necessario. In caso di estensione della rima di dissezione alla sola aorta ascendente, quest’ultima deve essere sempre asportata, mentre in caso di localizzazione alla radice aortica, all’arco o all’aorta toracica discendente la sostituzione con tubo protesico va eseguita solo se aneurismatici (in caso di coinvolgimento dell’aorta discendente tale procedura può essere eseguita in un secondo momento). Alla luce di tali considerazioni l’approccio da noi utilizzato nel trattamento di tale patologia è il seguente: in caso di localizzazione della breccia intimale a livello dell’aorta ascendente e con una radice aortica conservata eseguiamo un intervento di sostituzione della sola aorta ascendente, utilizzando eventualmente colla biologica per riaccollare le tuniche dissecate; in caso di breccia localizzata in aorta ascendente, ma con interessamento della rima di dissezione della radice aortica eseguiamo un intervento di sostituzione dell’aorta ascendente e della radice con reimpianto della valvola nativa (se non danneggiata) all’interno della protesi o sostituendo la stessa (tecnica di Bentall-DeBono) e reimpiantando gli osti coronarici al tubo protesico; in caso di localizzazione della breccia a livello dell’arco aortico se non vi è interessamento dei tronchi sovraortici eseguiamo un intervento di sostituzione dell’aorta ascendente e dell’emiarco, mentre se anche i tronchi sovraortici sono danneggiati allora bisogna sostituire l’intero arco aortico. In questo caso per eseguire l’intervento è necessario sospendere la circolazione sistemica (cosiddetto arresto di circolo) ed impiegare una delle metodiche di protezione dall’ischemia cerebrale: ipotermia profonda con arresto di circolo, perfusione cerebrale retrograda e perfusione cerebrale anterograda. Il razionale dell’impiego dell’arresto di circolo ipotermico è legato all’evidenza clinico-sperimentale dell’efficace protezione tissutale di cui è capace l’ipotermia: l’effetto protettivo cerebrale è in rapporto al grado d’ipotermia, per cui si ritiene esserci un tempo, detto “safe period”, la cui durata è inversamente proporzionale al grado di temperatura e durante il quale non si evidenzierebbero danni funzionali clinicamente evidenti. Durante tale periodo le richieste metaboliche tissutali sono ridotte al minimo, ma non annullate. La temperatura naso-faringea che in genere si raggiunge oscilla tra i 15 e i 18°C, permettendo un “safe period” di 32-40 minuti. La perfusione cerebrale retrograda è sempre associata all’ipotermia sistemica profonda ed utilizza sangue freddo ed ossigenato, infuso mediante il circuito della circolazione extracorporea: il sangue viene spinto in cava superiore (attraverso una cannula posizionata in vena cava superiore utilizzata per il drenaggio venoso durante normale bypass cardiopolmonare) o direttamente nelle vene giugulari (mediante cannulazione delle stesse) e fatto ritornare in aorta attraverso l’arteria carotide di sinistra ed il tronco anonimo. I vantaggi di questa tecnica non sono tanto rappresentati dal fatto di fornire substrati metabolici al cervello (non tutto il sangue ossigenato raggiunge i capillari a causa della presenza di shunts artero-venosi precapillari), ma di permettere un raffreddamento cerebrale uniforme, la facile eliminazione dell’aria dai vasi epiaortici, la rimozione di eventuali tossine neurologiche e di altre sostanze prodotte durante il metabolismo ischemico. Negli ultimi anni tali tecniche sono state sempre meno utilizzate, privilegiando la perfusione cerebrale anterograda, perfondendo, cioè, il tronco anonimo e la carotide di sinistra, introducendo le cannule direttamente nel lume arterioso subito dopo l’arresto di circolo (tecnica di Kazui). Tale tecnica rappresenta la metodica più efficace nel prevenire i danni ischemici cerebrali e quindi permette di prolungare il “safe period” durante l’arresto di circolo [2].
MATERIALE E METODO Dall’aprile 1993 al dicembre 2008 presso la nostra Struttura Complessa di Cardiochirurgia 170 pazienti (età media 60±11 anni, 81% maschi) sono stati sottoposti ad intervento chirurgico per sindrome aortica acuta: in 150 pazienti era stata diagnosticata una dissezione aortica acuta (89%), in 6 pazienti (2%) un’ulcera perforante ed in 14 (8%) un ematoma intramurale. Nel 75% dei casi (127 pazienti) si trattava di una dissezione aortica acuta di tipo I di DeBakey, nel 25% (43 pazienti) di tipo II di DeBakey. La maggior parte dei pazienti riferiva una storia di ipertensione arteriosa (70%), il 17% presentava un aneurisma dell’aorta ascendente, nel 6% dei casi la valvola aortica era bicuspide ed il 2% era affetto da Sindrome di Marfan. La diagnosi definitiva di sindrome aortica è stata ottenuta mediante ecocardiografia (sia transtoracica che transesofagea), tomografia computerizzata con mezzo di contrasto e risonanza magnetica nucleare. Le procedure chirurgiche eseguite sono state: sostituzione dell’aorta ascendente con tubo protesico in 118 pazienti (70%), asportazione dell’aorta ascendente ed “end-to-end anastomosis” in 6 pazienti (3,5%), sostituzione dell’aorta ascendente, della valvola aortica e reimpianto degli osti coronarici secondo Bentall-De Bono in 7 pazienti (4%), sostituzione del bulbo aortico con reimpianto della valvola aortica nativa all’interno di un condotto protesico (valve sparing procedure secondo David) in 6 pazienti (3,5%), sostituzione dell’aorta ascendente e dell’arco in 33 pazienti (19%). Una volta dimessi i pazienti venivano inseriti in un rigido protocollo di controlli cardiologici clinico-strumentali in modo da valutare eventuali complicanze che si possono verificare nei mesi successivi all’intervento. Controlli clinici sono stati eseguiti ogni 3 mesi durante il primo anno dopo intervento chirurgico, successivamente ogni 6 mesi, mentre ecocardiogramma e tomografia computerizzata venivano effettuati ogni sei mesi durante il primo anno e successivamente a cadenza annuale.
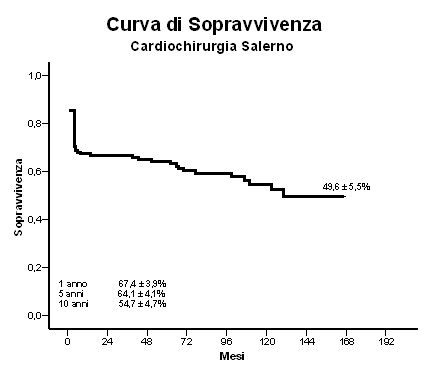 RISULTATI La degenza media ospedaliera è stata di 18±21 giorni. Nell’immediato decorso postoperatorio il 30% dei pazienti ha sviluppato un’insufficienza renale acuta, nel 20% era presente un deficit neurologico, l’ischemia mesenterica si è presentata nell’8% dei casi, mentre infarto del miocardio ed ischemia d’arto nel 6% dei casi. La mortalità ospedaliera è stata del 26% (44 pazienti). Da un’analisi statistica è emerso che né il tipo di intervento, né le tecnica di protezione cerebrale adottata rappresentavano fattori di rischio per mortalità ospedaliera. L’età superiore ai 70 anni era gravata dalla più alta incidenza di mortalità (37%, p: 0,05), mentre quelli con età inferiore a 40 anni presentavano una mortalità del 17% (p: 0,05). Da tale analisi è emerso anche che maggiore era l’intervallo di tempo tra comparsa dei sintomi ed intervento, maggiore era la mortalità. Infatti nel gruppo di pazienti operati entro 420 minuti dall’esordio clinico della patologia (98 pazienti) la mortalità era del 22% (22 pazienti), mentre in quello operato dopo i 420 minuti (72 pazienti) era del 38% (27 pazienti, p: 0,04). Durante il follow-up (1-167 mesi, media±DS: 68±38 mesi) sono stati seguiti 126 pazienti, registrando una mortalità del 18% (22 pazienti). I decessi correlati alla patologia aortica sono stati però soltanto 9: 4 pazienti sono deceduti per ridissezione prossimale, 1 per rottura di un aneurisma dell’aorta addominale, 4 per morte improvvisa. Né la persistenza del falso lume, né l’estensione della sostituzione aortica sono emersi come fattori chirurgici di rischio di morte tardiva (p: non significativa). L’analisi di sopravvivenza effettuata utilizzando la tecnica attuariale di Kaplan-Meier ha evidenziato una sopravvivenza ad un anno del 57,4±3,9%, a 5 anni del 64,1±4,1%, a 10 anni del 54,7±4,7% ed al termine del follow-up (circa 14 anni) del 49,6±5,5% (grafico 1).
RISULTATI La sindrome aortica acuta è gravata da un’alta mortalità, in rapporto alla tendenza della rottura completa dell’aorta a livello della lesione intimale primaria. La prognosi è certamente peggiore nella dissezione aortica acuta di tipo A: diversi autori riportano, in assenza di trattamento medico o chirurgico, un tasso di mortalità di circa 1%/h, corrispondente ad una mortalità del 50% entro le 48h dall’esordio della sintomatologia clinica [2]. Negli ultimi anni, tuttavia, il miglioramento delle tecniche diagnostiche e la tempestività del trattamento medico-chirurgico hanno ridotto la mortalità e migliorato la prognosi a distanza: secondo l’International Registry of Acute Aortic Dissection (IRAD) la mortalità entro 30 giorni in caso di esclusivo trattamento medico è del 54% e 9% in caso di dissezione aortica di tipo A e B, mentre in caso di terapia chirurgica è del 27% e 29%, rispettivamente [6]. La nostra esperienza, in linea con tali dati, ha evidenziato quali fattori predittivi di mortalità, oltre all’età superiore ai 70 anni, anche l’intervallo di tempo trascorso tra esordio delle manifestazioni cliniche ed intervento chirurgico, che se superiore ai 420 minuti era significativamente associato ad elevata mortalità operatoria. Tuttavia, nonostante i progressi della diagnostica e delle tecniche chirurgiche, il trattamento della sindrome aortica acuta di tipo A resta associato ad un’alta morbilità e mortalità ospedaliere che presso la nostra Struttura Complessa di Cardiochirurgia è stata del 26% (44 pazienti). Perciò tale patologia rappresenta un’emergenza chirurgica indifferibile in quanto gravata da un’elevata mortalità. Al contrario, i pazienti con dissezione aortica di tipo B vengono indirizzati verso la terapia medica (farmaci antipertensivi), riservando la chirurgia solo in caso di complicanze (persistenza del dolore toracico, evidenza di aneurisma in espansione, segni di rottura, ischemia agli organi addominali o agli arti inferiori) [4]. Infine, secondo la nostra esperienza, l’estensione dell’atto chirurgico e le varie tecniche di protezione cerebrale utilizzate non influenzano il risultato operatorio, mentre nel follow-up a distanza non sono stati identificati fattori di rischio per la morte improvvisa e la ridissezione aortica. In conclusione, la dissezione acuta dell’aorta è una grave patologia, il cui trattamento chirurgico, quasi sempre in emergenza, a volte non consente, ai fini della sopravvivenza, soluzioni chirurgiche lunghe e complesse. Il cardiochirurgo è quasi obbligato a contentarsi di fare un intervento salvavita, anche se magari non ottimale. La diagnosi precoce potrebbe favorire il risultato chirurgico (da qui la necessità di identificare eventuali markers bioumorali che ne faciliterebbero il compito). Inoltre, la stessa dissezione è un processo in evoluzione, che può necessitare di ulteriori interventi chirurgici nel tempo, dopo il primo, a causa dell’evoluzione della dissezione primitiva (dilatazione e/o rottura), della comparsa di una nuova dissezione aortica o per lo sviluppo di un falso aneurisma.
BIBLIOGRAFIA
1. Evangelista Masip A. Natural History and Therapeutic Management of Acute Aortic Syndrome. Rev Esp Cardiol 2004;57(7):667-79. 2. Erbel R, Alfonso F, Boileau C, Dirsch O, Eber B, Haverich A, et al. Diagnosis and management of aortic dissection: recommendations of the Task Force on Aortic Dissection, European Society of Cardiology. Eur Heart J 2001;22:1642-1681. 3. Hayter RG, Rhea JT, Small A, Tafazoli FS, Novelline RA. Suspected Aortic Dissection and Other Aortic Disorders: Multi–Detector Row CT in 373 Cases in the Emergency Setting. Radiology 2006;238:841-852. 4. Bojar RM. Synopsis of adult cardiac surgical disease – Aortic dissections. In Bojar RM, eds. Manual of perioperative care in adult cardiac surgery. 4th ed. Massachusetts: Blackwell Publishing; 2008:33-36. 5. Kouchoukos NT, Dougenis D. Surgery of the thoracic aorta. N Engl J Med 1997;336:1876-1888. 6. Eagle KA, Bruckman D, Isselbacher E, Evangelista A, Fattori R, Oh JK, et al. Predictive of mortality in patients with type A acute aortic dissections – results from the International Registry of Acute Aortic Dissection (IRAD). J Am Coll Cardiol 2000;35:323.
|
