
|
la gestione “medica” del paziente con dissezione aortica.
Pio Caso, Luigi Nunziata*, Sara Hana Weisz*, Giuseppe Petrone, Guido Tassinario*,Sergio Severino, Raffaele Calabrò* U.O.S. Diagnostica Non Invasiva-Dipartimento di Cardiologia AO Monaldi (NA) *Cattedra di Cardiologia – Seconda Università degli Studi di Napoli – AO Monadi Napoli
Dissezione aortica Nell’ambito delle sindromi aortiche acute, la dissecazione è la patologia più rappresentata. E’ tra le malattie cardiovascolari a più alta mortalità, con una incidenza di circa 5-20 persone/milione/anno, e generalmente è caratterizzata da una presentazione acuta che insorge come evento drammatico. È caratterizzata da una improvvisa lacerazione della parete intimale del vaso, che consente al sangue, spinto dalla forza della pressione arteriosa, di formare un secondo lume detto "falso lume". La colonna di sangue che avanza in genere si estende distalmente e, meno comunemente, in senso prossimale, a partire dall'iniziale lacerazione intimale. La dissezione si verifica all'interno della media e può rompersi verso l'avventizia o al contrario verso l'intima. La dissezione dell'aorta può avere origine a qualunque livello, ma le sedi più comuni sono l'aorta ascendente prossimale entro 5 cm dalla valvola aortica e l'aorta discendente toracica appena al di sotto dell'origine dell'arteria succlavia sinistra. Raramente, la dissezione è confinata a singole arterie (es. le arterie coronarie o carotidi). La morte spesso avviene per rottura dell'aorta, abitualmente all'interno della cavità pericardica o della cavità pleurica sinistra.1
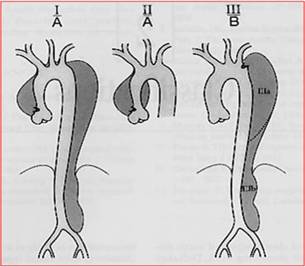
Classificazione In rapporto alla sede ed alla estensione della dissezione sono state proposte varie classificazioni, le tre classificazioni attuali effettuano tale distinzione (se la zona ascendente è interessata o meno).2,3,4 (Fig.1) · DeBakey o Tipo I – nasce nell’aorta ascendente e si estende o Tipo II – confinato nell’aorta ascendente o Tipo III – nasce nell’aorta discendente e si estende · Stanford o Tipo A – se coinvolge l’aorta ascendente o Tipo B – se non coinvolge l’aorta ascendente
· Descrittivo o Prossimale – Tipo I e II di DeBakey e Tipo A di Stanford o Distale - Tipo III DeBakey e Tipo B di Stanford
Fig.1 Classificazione di De Bakey e Stanford
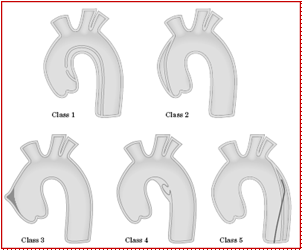
1. Nuova Classificazione (European Society of Cardiology)1 (Fig.2) o Classe 1: Dissezione aortica tipica con flap intimale tra vero e falso lume o Classe 2: Ematoma/Emorragia Intramurale o Classe 3: Discreta/Subtotale Dissezione senza ematoma o Classe 4: Placca Aortica Ulcerata o Classe 5: Dissezione Iatrogena / Traumatica
Fig.2 Nuova Classificazione
Circa il 70% delle dissecazioni avviene nel tratto ascendente, che è anche il punto più pericoloso per la sopravvivenza del paziente. La dissezione è considerata acuta se < 2 sett. e cronica se > 2 sett.
Eziologia Nel meccanismo patogenetico di questa malattia si riconoscono fattori predisponesti generali e locali su cui interagiscono fattori che determinano l'evento acuto dissecante.5
I Fattori predisponenti sono: · I processi degenerativi della parete aortica: si identificano nella medionecrosi cistica di Erdheim, caratterizzata da frammentazione delle fibre elastiche, perdita di cellule muscolari lisce, fibrosi ed accumulo di sostanza mucide in spazi pseudocistici. La degenerazione aumenta con l' età, l' ipertensione arteriosa o condizioni che aumentano lo stress emodinamico sulle pareti vasali. · Anomalie genetiche: sindrome di Marfan e sindrome di Ehler-Danlos. · Ectasia anuloaortica. · Valvola aortica bicuspide. · Aterosclerosi. · Coartazione aortica. · Gravidanza (3° trimestre e primi mesi del puerperio): essa può condizionare un aumento della pressione arteriosa differenziale ed effetti ormonali sulla struttura dei tessuti connettivi. I Fattori determinanti sono : · I traumi accidentali del torace. · Lesioni iatrogene: cannulazione aortica, anastomosi prossimale di un bypass aortocoronarico, etc.
Manifestazioni cliniche L’esordio clinico avviene con dolore toracico, presente in quasi tutti i pazienti con normale stato di coscienza. Il dolore insorge in maniera brusca ed è di intensità insopportabile. Viene spesso definito come lacerante o trafittivo (cosiddetto "a colpo di pugnale"), spesso accompagnato da manifestazioni vagali quali sudorazione, nausea, vomito e perdita di coscienza. Con la diminuzione del flusso sanguigno ad organi importanti possono verificarsi deficit neurologici centrali (sincope, emiparesi) o midollari (tetraplegia o paraplegia). La localizzazione più comune è il precordio, talvolta addome ed è frequente un dolore nell'area interscapolare, soprattutto quando la dissezione coinvolge l'aorta discendente toracica. Il dolore della dissezione aortica è spesso migrante, cioè si sposta frequentemente dalla sede di origine della lacerazione intimale lungo l'estensione della lesione aortica. Occasionalmente, la dissezione si presenta con sintomi riferibili a occlusione arteriosa acuta (es., ictus, IMA o infarto intestinale, paraparesi o paraplegia per interruzione dell'apporto ematico al midollo spinale o ischemia di un arto). Tale quadro clinico può mimare un'embolia arteriosa. Nei 2/3 dei pazienti circa si riscontra una riduzione o la totale assenza dei principali polsi arteriosi, talora ad andamento intermittente. Un soffio da insufficienza aortica è rilevabile nei 2/3 dei pazienti portatori di una dissezione prossimale, essa può essere dovuta ad una dilatazione della radice aortica o dell' anulus in modo che le cuspidi valvolari non coaptino più. Possono essere presenti i segni periferici dell'insufficienza aortica. Raramente, una grave insufficienza aortica acuta può causare insufficienza cardiaca. Alcuni pazienti presentano una grave ipertensione sistemica. Altre volte, possono essere presenti ipotensione e shock dovuti a tamponamento cardiaco, rottura intrapleurica o intraperitoneale o ancora alla dissezione dei tronchi sopra aortici. È comune un versamento pleurico sinistro, dovuto a una raccolta infiammatoria sierosa periaortica o a stravaso di sangue nella cavità pleurica sinistra. Le complicanze neurologiche comprendono ictus, paraparesi o paraplegia da ischemia del midollo spinale e neuropatie ischemiche periferiche da brusca occlusione dell'arteria che fornisce sangue all'arto. La fuoriuscita di sangue dalla dissezione all'interno della cavità pericardica può causare tamponamento cardiaco. Sono comuni una leucocitosi e un'anemia di grado lieve, se si ha uno stravaso di sangue fuori dall'aorta (bisogna sempre considerare la possibilità che del sangue venga aspirato dalla pleura sinistra). L'AST e la CK sono solitamente normali. La LDH può essere aumentata per l'emolisi che può verificarsi all'interno del falso lume.6
Registro IRAD Nel 1996 è stato istituito un registro internazionale, denominato International Registry of Acute Aortic Dissection (IRAD), con lo scopo, quindi, di identificare ed approfondire le caratteristiche epidemiologiche, cliniche, diagnostiche e terapeutiche della malattia, allo stato dell’arte. L’IRAD è un registro multicentrico che raccoglie i dati clinici di 22 centri cardiovascolari presenti in 8 paesi, quali gli Stati Uniti, il Giappone, la Svizzera, l’Austria, la Germania, la Spagna, la Norvegia e l’Italia. Questi dati, raccolti attraverso un “data-form” standard con 290 variabili, sono inviati per l’elaborazione al centro coordinatore presso l’Università del Michigan (USA). Il Registro ha fatto conoscere e divulgare molti dati inerenti le dissecazioni, tra i molti dati, l’IRAD ha confermato essere il sesso maschile il più colpito dall’evento dissecativo, con un rapporto M/F di 2/1, mentre l’età più interessata è stata la settima decade. Le forme di tipo A, ad origine dall’aorta ascendente sono risultate circa il 60%, più comuni quindi rispetto alle forme di tipo B, ad origine dopo l’emergenza dell’arteria succlavia sinistra. Curiosamente, l’età media dei pazienti europei è risultata più bassa rispetto a quella dei pazienti arruolati nei centri del nord america (59.7 vs 63.6, p<0.001), i quali peraltro erano stati con più frequenza già sottoposti a terapie chirurgiche e/o endovascolari, per patologie aortiche o cardiache. Nella storia dei pazienti IRAD, l’ipertensione è stata evidenziata in circa 3 casi su 4, mentre disordini genetici predisponenti, come la Sindrome di Marfan e la bicuspidia valvolare aortica, si sono rivelati in circa il 5% dei pazienti. Il dolore toracico ha interessato la quasi totalità dei casi (95%), mostrando caratteristiche differenti nelle forme A, ove è risultato localizzato più anteriormente, rispetto alle B, ove era più presente in sede interscapolare. L’ipertensione arteriosa è stata rilevata maggiormente nei pazienti “B” rispetto agli “A”, ove invece l’ipotensione, l’assenza di polsi arteriosi e lo stroke sono stati più comuni. In circa il 31% di questi pazienti l’ECG era nella norma, mentre l’RX del torace ha mostrato una dilatazione mediastinica o un contorno aortico anormale (quasi l’80% dei casi). Il primo esame diagnostico strumentale nei pazienti IRAD è stato la TC, ed in circa il 60% dei casi più esami si sono resi necessari. Nel Registro, la mortalità ospedaliera nelle forme di tipo A, con indicazione all’intervento chirurgico, è stata del 23%, mentre nelle forme B, indipendentemente dal trattamento, medico, chirurgico o endovascolare, è stata del 12% circa. La stabilità o l’instabilità clinica di questi pazienti all’arrivo in ospedale, caratterizzata, quest’ultima, dalla presenza o meno di infarto miocardico, stroke, tamponamento cardiaco, versamento pleurico, ematoma periaortico, ischemia viscerale, insufficienza renale acuta, od ischemia degli arti inferiori, sono risultate essere il principale fattore predittivo del decorso post-trattamento, sfavorevole in caso di instabilità.7,8,9
Presidi diagnostici per la dissezione aortica v Angiografia v Ecocardiografia (TTE+TEE) v TAC v RMN Lo studio della dissecazione aortica è fondato dall’evidenza di: breccia di entrata, falso lume e rapporto di questo con il vero lume, estensione della dissecazione, presenza di breccia di rientro, coinvolgimento dei vasi che originano dall’aorta e loro pervietà, origine di questi ultimi dal vero o dal falso lume. Sono tutti dati fondamentali a porre l’indicazione o meno all’intervento chirurgico e per programmare una adeguata strategia.
Angiografia L’angiografia è una metodica che per la sua invasività, e la lunghezza dei tempi è ormai ritenuta di seconda scelta nella diagnosi delle dissecazioni di tipo B rispetto al TEE o alla TC o alla Angio-RMN. E’ rivalutata per il trattamento endovascolare delle dissezioni (posizionamento di stent graft, fenestrazione del lembo di dissezione). Ecocardiografia Transtoracica L'ecocardiografia transtoracica bidimensionale trova un’ampia indicazione alla diagnosi di dissezione. Ha una sensibilità che varia dal 59% all’85% ed una specificità che varia tra il 63% ed il 96%. Essa consente di identificare in maniera assolutamente affidabile la dissezione dell'aorta ascendente, ma non quella dell'aorta discendente. Si può di solito evidenziare il flap intimale flottante nel lume aortico, il vero ed il falso lume e rilevare anche gradi subclinici di rigurgito aortico. Il flap deve essere visualizzato in diverse proiezioni, deve muoversi indipendentemente dalle pareti aortiche e strutture cardiache. Il color Doppler dell’ecocardiogramma transtoracico e transesofageo aiuta ad individuare l’ingresso del falso lume e valutare la gravità del rigurgito aortico, quest’ultimo dovuto ad una dilatazione della radice aortica o dell' anulus in modo che le cuspidi valvolari non coaptino più . Talvolta riverberi o altri artefatti possono causare dell’iperecogenicità lineari simulanti una dissezione aortica. Criteri differenziali degli artefatti lineari sono: § Gli artefatti hanno margini non ben definiti § Talvolta si estendono al di fuori della parete aortica § Mancano i movimenti oscillatori tipici dei flaps § Il pattern color-Doppler non viene modificato dalla presenza dell’artefatto10,11
Ecocardiografia Transesofagea L’ecocardiografia transesofagea è una metodica molto sensibile e specifica per diagnosticare la dissezione aortica. Essa identifica brecce intimali da dissezioni molto limitate, molte delle quali sono asintomatiche. La sua sensibilità per la diagnosi di dissezione aortica è del 98-99%, molto simile alla RMN e la TAC, mentre la sensibilità nell’individuare una rottura intimale è del 73%, la specificità dell’ETE è compresa tra il 94-97%.
Indicazione all’ETE: Ø Definire la sede della dissezione dell’intima (anche se piccola) Ø Rilevare il coinvolgimento degli osti coronarici Ø Valutazione peri-operatoria (localizzazione della breccia di ingresso, flusso dal vero lume) Ø Costituire la base dei successivi follow-up
TEE Criteri Anatomici della Dissezione aortica: Ø BRECCIA: interruzione continuità flap (valutazione anatomica e color-Doppler) Ø VERO LUME: espansione sistolica e collasso diastolico, assenza di contrasto spontaneo, jet sistolico dal vero verso il falso lume. Ø FALSO LUME: espansione diastolica, contrasto spontaneo o trombosi, flusso ritardato o assente.
Vantaggi ETE: o Accuratezza elevata o Semplice esecuzione o Poco invasiva o Ripetibile o No contrasto o No radiazioni o Ampiamente disponibile o Basso costo o Eseguibile in situazioni diverse: · a letto del paziente, in sala operatoria, in UTIC etc.
Limiti ETE: o Operatore dipendente o Non ottimale per il tronchi sopraaortici o Fastidiosa per il paziente o Non dà informazioni precise sull’estensione del falso lume a livello dell’aorta addominale e sui vasi splancnici che originano da essa12,13
TAC e Risonanza Magnetica Nucleare La TAC e la RM sono entrambe metodiche altamente sensibili. Esse sono in grado di evidenziare il falso lume e seguire l’aorta fino alla sua biforcazione, rivelando l’interruzione dei suoi rami. La TC con mezzo di contrasto rappresenta una delle metodiche strumentali più utilizzate per confermare il sospetto di una dissezione aortica, avendo una elevata sensibilità nell' individuare la lesione così come anche l'ecocardiografia transesofagea. Altrettanto valida nell’identificare la lesione aortica è la Risonanza Magnetica che rappresenta un' indagine accurata nei casi di pazienti emodinamicamente stabili, mentre risulta non proponibile in acuto per i prolungati tempi di esecuzione e le difficoltà di accesso dei pazienti, spesso emodinamicamente instabili e sotto supporto ventilatorio. La sua sensibilità e specificità sono di circa il 100%. Essa risulta, peraltro molto utile nel follow-up a distanza del paziente operato.
Limiti TAC: o radiazioni ionizzanti o uso di contrasto o non utile per insufficienza aortica o sensibilità non eccellente (senza mdc)
Limiti RM: o scarsa disponibilità o non indicata in pz instabile o controindicata in portatori di pace-makers, clips metalliche etc14
Gestione medica del paziente con dissezione aortica Dinanzi a un paziente con un quadro clinico suggestivo di dissezione aortica (in riferimento ai dati del registro IRAD), il compito del medico sarà: 1) Fare una diagnosi rapida e corretta 2) Decidere rapidamente il trattamento Nelle Dissezioni di tipo I e II ( A ) è indicato un trattamento chirurgico d’urgenza, poiché elevata è la probabilità di rottura in tempi brevi, mentre nelle dissezioni di tipo III ( B ) appare più indicata la terapia medica con farmaci ipotensivanti al fine di ridurre il rischio di rottura della parete aortica, riservando la terapia chirurgica e/o endoscopica solo ai pazienti con grave ischemia viscerale, midollare e degli arti inferiori e/o espansione continua dell’aorta con elevato rischio di rottura. L’obiettivo principale della terapia è costituito dall’impedire la progressione della dissezione e la rottura dell’aorta con conseguenze letali. In fase acuta, si usa generalmente l'associazione di nitroprussiato di sodio e di un -bloccante. Il nitroprussiato va somministrato in infusione EV continua, cominciando con 0,2-0,3 mg/kg/min e aumentando la dose come necessario per ottenere un controllo ottimale della PA. Sono spesso necessarie dosi elevate (200-300 mg/min). Lo scopo è ottenere una riduzione della PA ai più bassi livelli compatibili con un'adeguata perfusione cerebrale, coronarica e renale. Poiché il nitroprussiato da solo ha un effetto tachicardizzante e può aumentare la velocità di contrazione del ventricolo sinistro (dP/dT), è obbligatoria la somministrazione contemporanea di un -bloccante. A questo scopo, si utilizza il propranololo EV alla dose iniziale di 0,5 mg, seguita da 1-2 mg q 3-5 min fino a che la frequenza si abbassa a 60-70 battiti/min o fino a una dose totale di 0,15 mg/kg nell'arco di 30-60 min. La medesima dose può essere ripetuta q 2-4 h per mantenere il -blocco. Nei pazienti che non tollerano il propranololo a causa di BPCO, asma bronchiale o cardiopatia, si possono somministrare -bloccanti cardioselettivi (p. es., metoprololo) EV in dosi equivalenti. In alternativa, si può usare acutamente l'esmololo, un -bloccante a breve durata d'azione, in infusione EV continua (50-200 mg/ kg/min). Se anche i -bloccanti selettivi non sono tollerati, un'alternativa ragionevole è rappresentata dal trimetafano camsilato, alla dose di 1-5 mg/min EV. Sebbene questo farmaco sia inizialmente efficace, si sviluppa rapidamente tachifilassi e il suo uso è limitato dalla comparsa di effetti collaterali simpatico-plegici ( es., ritenzione urinaria, ileo paralitico e offuscamento della vista). Altri farmaci utili nel trattamento della fase acuta sono i calcioantagonisti (es., verapamil 0,05-0,1 mg/kg EV). Il labetalolo, che ha proprietà sia α che -bloccanti, viene somministrato alla dose iniziale di 5-20 mg EV; dosi addizionali di 20-40 mg possono essere somministrate q 10-20 min, fino a ottenere un buon controllo dei valori pressori. La dose totale iniziale EV non deve essere 300 mg. Dosi simili di labetalolo possono essere somministrate q 4-8 h, al bisogno. In alternativa, il labetalolo può essere somministrato in infusione EV continua alla dose di 1-2 mg/min. Si ritiene che siano controindicazioni assolute alla chirurgia la presenza di uno shock evolutivo con anuria > 6 ore, para o tetraplegia da ischemia midollare. Il riscontro di un flap intimale in aorta ascendente (Tipo A), di segni di rottura aortica (emopericardio, emomediastino, emotorace) anche nel tipo B orientano verso la terapia chirurgica nel caso di dissezione acuta. La dissezione cronica di qualunque tipo e la dissezione acuta “non complicata” di tipo B orientano verso la terapia medica con successivi follow-up. L’ematoma intramurale, allo stato attuale, segue le stesse indicazioni della dissezione aortica. (Tab. 1). La mortalità chirurgica nei più importanti centri specializzati nel trattamento della dissezione aortica è di circa il 15% per la dissezione aortica prossimale e un po' più alta per la dissezione distale. Tutti i pazienti, compresi quelli trattati chirurgicamente, devono essere sottoposti a terapia medica a lungo termine, che generalmente consiste in una combinazione di -bloccanti o calcioantagonisti e altri farmaci antiipertensivi, soprattutto ACE-inibitori. Qualunque combinazione di farmaci antiipertensivi è accettabile, eccetto quelli che agiscono principalmente come vasodilatatori (es., idralazina, minoxidil) o -bloccanti con attività simpatico-mimetica intrinseca (es., pindololo, acebutololo).15,16
Bibliografia 1. Erbel R, Alfonso F, Boileau C, Dirsch O, Eber B, Haverich A, Rakowski H, Struyven J, Radegran K, Sechtem U, Taylor J, Zollikofer C, Klein WW, Mulder B, Providencia LA. Diagnosis and management of aortic dissection: task force report of the European Society of Cardiology. Eur Heart J 2001; 22:1642–1681. 2. Daily P, Trueblood H, Stinson, Wuerflein R, Shumway N. Management of acute aortic dissections. Ann Thorac Surg 1970;10:237–47. 3. DeBakey M, McCollum C, Crawford E, Morris G, Howell J, Noon G. Dissection and dissecting aneurysms of the aorta: twenty-year follow-up of five hundred twenty-seven patients treated surgically. Surgery 1982;92:1118–34. 4. Svensson LG, Labib SB, Eisenhau JR. Intimal tear without haematoma. Circulation 1999;99:1331–6. 5. Ahmad F, Cheshire N, Hamady M. Acute aortic syndrome: pathology and therapeutic strategies. Postgrad Med J 2006;82:305–12.
6.
Armstrong WF, Bach DS, Carey LM, Froehlich J, Lowell M,
Kazerooni EA. Clinical and echocardiographic findings in
patients with suspected acute aortic dissection. 7. Hagan PG, Nienaber CA, Isselbacher EM, Bruckman D, Karavite DJ, Russman PL, Evangelista A, Fattori R, Suzuki T, Oh JK, Moore AG, Malouf JF, Pape LA, Gaca C, Sechtem U, Lenferink S, Deutsch HJ, Diedrichs H, Marcos y Robles J, Llovet A, Gilon D, Das SK, Armstrong WF, Deeb GM, Eagle KA. The International Registry of Acute Aortic Dissection (IRAD): new insights into an old disease. JAMA 2000;283:897-903. 8. Tsai TT, Trimarchi S, Nienaber CA. Acute aortic dissection: perspectives from the International Registry of Acute Aortic Dissection (IRAD). Eur J Vasc Endovasc Surg. 2009 Feb;37(2):149-59. Epub 2008 Dec 20. 9. Tsai TT, Evangelista A, Nienaber CA, Trimarchi S, Sechtem U, Fattori R, Myrmel T, Pape L, Cooper JV, Smith DE, Fang J, Isselbacher E, Eagle KA. Long-term survival in patients presenting with type A acute aortic dissection: insights from the International Registry of Acute Aortic Dissection (IRAD).Circulation. 2006 Jul 4;114 (1 Suppl):I350-6 10. Miller D. Surgical management of aortic dissections: Indications, perioperative management and long term results. In: Doroghazi RM Slater EE, eds. Aortic Dissection. New York: McGraw-Hill; 1983. pp. 193–243. 11. Appelbaum A, Karp R, Kirklin J. Ascending vs descending aortic dissections. Ann Surg 1976;183:296–300. 12. Evangelista A, Gonzalez-Alujas M, Garcia del Castillo H, Anivarro I, Angel J, Salas A et al. Transesophageal echocardiography in the diagnosis of aortic dissection. Revista Espanola de Cardiologia 1993;46:805–9. 13. E. Louise Meredith and Navroz D. Masani Echocardiography in the emergency assessment of acute aortic syndromes. Eur J of Echocardiography (2009) 10, i31–i39 14. Shiga T, Wajima Z, Apfel C, Inoue T, Ohe Y. Diagnostic accuracy of transoesophageal echocardiography, helical computed tomography, and magnetic resonance imaging for suspected thoracic aortic dissection: systematic review and meta-analysis. Arch Int Med 2006;166:1350–6. 15. Ince H, Nienaber CA. Diagnosis and management of patients with aortic dissection. Heart 2007; 93 (2): 266-270. Review 16. Benedetto F.A., Chirillo F., Labanti G. Dissezione aortica in Linee Guide SIEC pp 454-461 Ed. SIEC servizi Srl Milano 2009
|
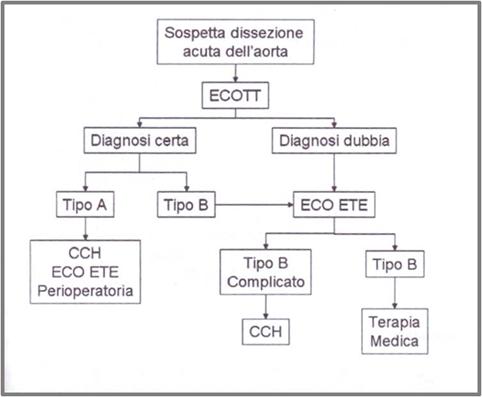 Tab.1
Decisione chirurgica
Tab.1
Decisione chirurgica