|
PROBLEMATICHE ASSISTENZIALI NEL CARDIOPATICO CON INSUFFICIENZA RENALE
Sabino Scardi, Paolo Umari, Renzo Carretta Scuola di Specializzazione in Cardiologia, Clinica Medica, Istituto di Medicina Clinica Università degli Studi di Trieste
Introduzione Il legame tra malattia renale e malattia cardiovascolare è importante. Infatti. undici milioni di americani soffrono d’insufficienza renale (IR) lieve o moderata e il loro numero é in progressivo aumento. Com’è noto, l’IR è un fattore di rischio coronarico ma anche un fattore di rischio di eventi nel follow-up quando la cardiopatia si è già instaurata. In questa rassegna valuteremo: -l’incidenza e la prevalenza di malattie cardiovascolari nell’IR cronica, -i fattori di rischio per malattia cardiovascolare nell’ IR cronica e se questa è, di per se, un fattore di rischio per malattia cardiovascolare, -l’outcomes dei pazienti con disfunzione renale e malattia cardiovascolare identificando i fattori di rischio che contribuiscono alla morbilità e mortalità cardiovascolare, -le possibili terapie cardioprotettive per ridurre il rischio e migliorare la sopravvivenza e l’outcomes. La disfunzione renale è stata associata con un rischio aumentato di mortalità, infarto miocardico, stroke e scompenso cardiaco nelle popolazioni ad alto rischio (1). Infatti, Deo et al (2), su 3044 pazienti di età 70-79 anni seguiti per 6 anni, hanno trovato che la disfunzione renale (valutata con Cistatina C) è fortemente predittiva di mortalità cardiovascolare in particolare nei soggetti senza storia di cardiopatia e nei pazienti dializzati o trapiantati. Inoltre, una disfunzione renale avanzata ( FG<60 mL) nello studio Replacement è un predittore indipendente di morte improvvisa ( p<0.001) nelle donne con malattia coronarica (3), in particolare, i pazienti con stadi molto avanzati di IR hanno un rischio di morte cardiovascolare di 10-20 volte superiore ai soggetti della stessa età e dello stesso sesso ma senza cardiopatia coronarica (4-5). Una revisione critica degli interventi diretti a modificare il profilo dei fattori di rischio cardiovascolare nei pazienti con IR cronica è stata condotta da Kaiser e Johnson (6) che, analizzando una lunga serie di trials compreso il LANDMARK (un studio clinico multidisciplinare d’ intervento su multipli fattori di rischio cardiovascolare), hanno concluso che i risultati di questi studi non sono conclusivi. Anche la gravità dell’IR incrementa il rischio di sopravvivenza nei nefropatici anziani, infatti, in uno studio di Fried et al man mano che incrementa il livello di creatininemia parallelamente aumenta il rischio di morte cardiovascolare (7).
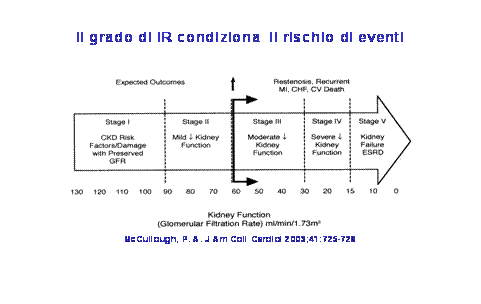
Come determinare la funzionalità renale La misura della creatininemia plasmatica o sierica è usata comunemente nella pratica clinica per stimare la funzionalità renale. Questa però costituisce una guida
Figura 1
solo approssimativa perché la sua sensibilità diagnostica per l’IR moderata è insufficiente. Per una più accurata determinazione della gravità dell’IR è necessario utilizzare la velocità di filtrazione glomerulare (VFG) che è misurata con la clearance della creatinina che si può calcolare utilizzando la formula di Cockcroft e Gault o la Modification of Diet in Renal Disease (MDRD) Study equation. Recentemente è stata adoperata la valutazione della Cistatina C, un inibitore competitivo della cisteina proteinasi lisosomiale la cui presenza è ritenuta uno stato preclinico di disfunzione renale. La determinazione della Cistatina C è considerata superiore alla clearance della creatinina perché evidenzia la disfunzione renale moderata (60-90 mL/min/1.73 m2) (8). Infatti, un’elevata concentrazione di Cistatina C nel Heart and Soul Study ha predetto un sostanziale rischio di morte, di malattia cardiovascolare e renale cronica, di eventi cardiovascolari e di scompenso cardiaco in 999 pazienti ambulatoriali con cardiopatia ischemica, rischio che non è predetto dalle altre misure della funzione renale usualmente utilizzate nella pratica clinica (9). La nuova classificazione proposta dalla Fondazione Nazionale Americana per il rene e dalla Dialysis Outcomes Quality Iniziative descrive 5 stadi di gravità della malattia renale (10-11), l’incremento di rischio cardiovascolare si realizza quando la VFG scende sotto i 60 ml/min per 1.73 m2, che corrisponde ad una creatininemia >1.5 mg/dl (Fig 1). Anche la microalbuminuria ( 30-300 mg/l) è un fattore di rischio, così come la macroalbuminuria >300 mg/l. Infatti, nel KEEP (12) fattori di rischio significativi
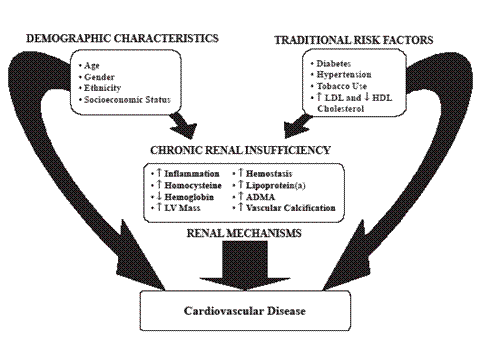
Figura 2
per lo sviluppo di malattie cardiovascolari sono risultate la microalbuminuria >30 mg/l (p<0.01) e la VFG 30-90 vs >90 mL/min ( p<0.001).
Fattori di rischio Nei pazienti con IR sono molti i fattori favorenti lo sviluppo dell’aterosclerosi coronarica; infatti, oltre ai demografici e ai tradizionali, vi sono quelli direttamente collegati con la presenza di IR ( incremento di infiammazione, omocisteina, massa ventricolare sinistra, emostasi, lipoproteina (a), calcificazione vascolare) che contribuiscono al “burden” cardiovascolare totale (Fig 2). Molti studi prospettici hanno dimostrato uno stretto rapporto tra IR e morbilità e mortalità cardiovascolare. Ad esempio, negli studi KEEP e NHANES 1999-2004 (13) la malattia renale cronica è indipendentemente associata con l’infarto miocardico e lo stroke e favorisce la mortalità a breve termine. In una popolazione di cardiopatici ischemici, la microalbuminuria, la macroalbuminuria e il ricorso alla dialisi sono risultati i maggiori fattori di rischio di mortalità dopo 10 anni di follow-up (5). Anche in Lombardia è stato osservato che, nei pazienti con disfunzione renale, la causa principale di morte era quella cardiaca (14). Similmente Bibbins-Domingo et al (15), valutando le cause di morte in donne con scompenso cardiaco e malattia coronarica, hanno identificato nella clearance della creatinina <60 ml/min il fattore di rischio maggiore. Anche il grado di disfunzione renale è fortemente predittivo di mortalità nei pazienti con infarto miocardio. Infatti, in rapporto al grado di IR, si osserva un progressivo incremento di mortalità cardiovascolare, recidiva infartuale, scompenso cardiaco, stroke ed end-point compositi (16). L’IR é un fattore di rischio di morte indipendente anche nei pazienti con scompenso cardiaco, mentre la somministrazione di ACE-inibitori (RR 0 46) e di betabloccanti ( RR 0.40) lo riduce nettamente (17). Questo incremento di mortalità nei pazienti con IR cronica è giustificato anche dallo scarso uso di terapie efficaci e dal ridotto numero di manovre procedurali invasive. L’insufficiente utilizzazione di procede interventistiche è condizionata dalla possibile comparsa di nefropatia da contrasto con cui si definisce l’IR post-procedurale per effetto nefrotossico del mezzo di contrasto associato a microembolia periferica. Essa è discretamente frequente e causa molti eventi avversi. E’ favorita dalla deplezione idrica, diabete, quantità di mezzo di contrasto e si verifica più frequentemente se la velocità di filtrazione è <60 ml. La si può prevenire con idratazione prima e dopo la procedura, utilizzando la minor dose possibile di mezzo di contrasto non ionico o con la somministrazione di N-acetilcisteina e si può curarla con emofiltrazione ed emodialisi (18).
Quale l’uso di terapie cardioprotettive? Reddan et al (19) hanno valutato l’uso delle terapie cardioprotettive durante il ricovero e alla dimissione dei pazienti con sindrome coronarica acuta nello studio SYNPHONY. L’utilizzo di aspirina, eparina, ACE-inibitori ed eparina a basso peso molecolare è nettamente ridotto nei pazienti con IR.. Questo problema è stato affrontato anche da Ezekowitz et al (20) analizzando, in rapporto al grado di IR, la somministrazione di farmaci cardiovascolari in 6.427 pazienti con scompenso cardiaco e cardiopatia ischemica. Man mano che incrementa il grado di IR, gradualmente ma significativamente si riduce la somministrazione da parte dei medici di aspirina, ACE-inibitori/sartani, betabloccanti, statine, tienopiridina, nitrati long-acting e warfarin. Viceversa se si utilizzano questi farmaci la mortalità si riduce nettamente. La situazione peggiora ulteriormente nei pazienti con stadio finale di malattia renale. Infatti Berger et al (21) hanno valutato la frequenza di somministrazione di farmaci cardioprotettivi in questi pazienti quando sono ricoverati per infarto miocardico acuto. Betabloccanti, ACE-inibitori ed aspirina sono nettamente poco utilizzati anche nei pazienti “idonei" a riceverli. Questo atteggiamento è stato definito “nichilismo" terapeutico.
Norme per una terapia razionale I pazienti con IR spesso devono essere trattati con farmaci cardiovascolari eliminati o metabolizzati principalmente dai reni. Ciò può incrementare l’accumulo di alcuni preparati ( digossina, betabloccanti idrosolubili, ACE-inibitori ecc. ). Inoltre, la somministrazione di farmaci a pazienti con ridotta funzione renale può causare problemi per: -alterazioni nell’ assorbimento, legame con le proteine plasmatiche e sensibilità recettoriale,
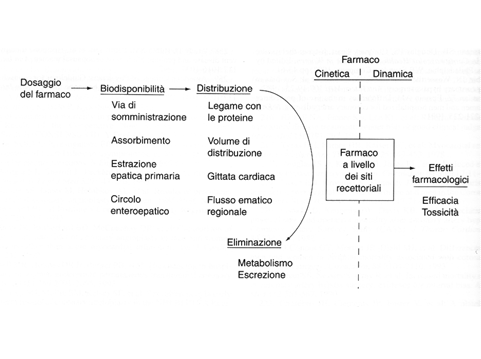
Figura 3
-incapacità di eliminazione con accumulo di metaboliti, -la sensibilità al farmaco può aumentare anche per turbe elettrolitiche, emodialisi, stato iperadrenergico, infiammazione cronica della mucosa gastrointestinale ecc., -molti effetti collaterali sono mal tollerati, -alcuni farmaci perdono di efficacia. Molti di questi effetti possono essere eliminati modificando la posologia o utilizzando farmaci alternativi con eliminazione prevalentemente epatica. Inoltre, per evitare complicazioni iatrogene è necessario seguire alcuni principi in particolare: -scegliere un regime terapeutico che tenga conto della velocità di filtrazione glomerulare, -correggendo il trattamento successivo tenendo conto della risposta clinica e delle concentrazioni plasmatiche del preparato utilizzato, -riducendo la dose giornaliera totale di mantenimento con la riduzione delle singole dosi o aumentando l’intervallo di somministrazione.
Scelta e somministrazione dei preparati cardioprotettivi La terapia cardiovascolare nei pazienti con disfunzione renale è gravata da numerose problematiche. Com’è noto, il dosaggio, la biodisponibilità, la distribuzione e la via di eliminazione di un farmaco ne condizionano il livello nei siti recettoriali da cui dipendono gli effetti farmacologici e perciò l’efficacia e la tossicità (Fig 3). Poiché i pazienti con IR usualmente sono esclusi dai grandi trias, in base alle segnalazioni riportate in letteratura, possiamo stilare queste indicazioni strategiche Betabloccanti Questi preparati hanno un metabolismo prevalentemente epatico, perciò possono essere utilizzati nei pazienti con IR, sono da evitare però atenololo, nadololo e sotalolo perché eliminati per via renale Antiaggreganti ed Eparine Questi farmaci possono causare problemi nell’IR grave, mentre fra gli inibitori delle Glicoproteine IIb/IIIa l’Epifibatide e il tirofibran, secreti per via renale, possono aumentare il rischio emorragico perciò è da preferire l’Abcximab. Il warfarin non ha alcuna limitazione, però è da evitare nell’IR grave. Antilipidemici Le statine non hanno controindicazioni nei pazienti con IR perché non sono metabolizzate a livello renale, tuttavia in presenza di un FG<30 ml è suggerita una riduzione del loro dosaggio. Alcuni trials hanno mostrato un effetto protettivo sugli eventi cardiovascolari, infatti le statine in alcune popolazioni a rischio, rallentano il declino della velocità di filtrazione glomerulare, riducono la proteinuria e sembra anche la morbilità e mortalità cardiovascolare tuttavia la dimostrazione reale di questo effetto non è disponibile. Tonelli et al (22) hanno studiato gli effetti della pravastatina nella prevenzione primaria e secondaria della cardiopatia ischemica nei soggetti con moderata disfunzione renale, osservando una riduzione di eventi cardiovascolari e della mortalità per tutte le cause nei soggetti trattati con statina in tutti i gradi di disfunzione renale definita utilizzando la formula di Cockcroft e Gault. Recentemente Shepherd et al (23) hanno analizzato i risultati della sottoanalisi dello studio TNT. L’atorvastatina 80 mg riduce il rischio relativo di eventi cardiovascolari maggiori del 32% nei pazienti ischemici con IR (p=0.0003) e del 15% in quelli con normale funzione renale. Sono in corso tre grandi trials: SHARP ( simvastatina + ezetimide vs placebo ), AURORA ( rosuvastatina vs placebo ) e LORD ( The Lipid lowering and Onset of Renal Disease ) con Atorvastatina vs placebo che ci forniranno una definitiva risposta sull’effetto protettivo delle statine nei pazienti con IR cronica. Antiaritmici Fra gli antiaritmici la digitale ( in disuso ) è eliminata per via renale, pertanto in presenza di IR è necessario iniziare con bassi dosaggi monitorando la frequenza cardiaca e la digossinemia. La somministrazione di amiodarone e di propafenone non ha problemi perché questi farmaci sono eliminati per via epatica, infine per la flecainide si consiglia una dose iniziale massima di 100 mg. Antipertensivi Per prazosina e clonidina non sono state suggerite modificazioni di dosaggio per FG> 50ml, mentre nessun problema sussiste per i calcioantagonisti che sono eliminati per via epatica. I diuretici possono essere usati ma con particolare attenzione all’ iponatriemia e alla deplezione dei volumi plasmatici, da usare con cautela i tiazidici e soprattutto i risparmiatori di potassio. Una particolare attenzione meritano gli ACE.-inibitori e i sartani o inibitori recettoriali dell’angiotensina. Questi farmaci sono largamente utilizzati per la cura dell’ipertensione arteriosa e dello scompenso cardiaco e dopo lo studio HOPE (24) anche per la prevenzione della cardiopatia ischemica. Il ruolo del blocco del sistema renina-angiotensina- aldosterone nel controllo dell’ipertensione arteriosa e dell’impatto positivo sull’outcomes è noto, infatti, questo blocco riduce il rischio di infarto miocardico, scompenso cardiaco e dell’outcomes cardiovascolare totale nei pazienti con proteinuria e in quelli con nefropatia diabetica (25). Nello studio HOPE (24) l’incidenza di outcome primario, di malattie cardiovascolari e di morti totali nei pazienti trattati con ramipril rispetto a quelli trattati con placebo era nettamente a vantaggio dei primi in presenza e in assenza di funzione renale alterata. Anche i Sartani hanno mostrato effetti renoprotettivi. Ad esempio l’ibesartan rispetto a placebo e amlodipina riduce l’end point primario, la creatininemia, la comparsa di IR grave e la mortalità per tutte le cause, nei pazienti con nefropatia secondaria a diabete mellito tipo 2 (26). In una metanalisi pubblicata recentemente gli ACE-I ed i Sartani riducono la proteinuria ma l’associazione dei due farmaci è più efficace. Tuttavia la sicurezza di questa combinazione ( in particolare nei pazienti in stadio 3-4) ha bisogno di ulteriori conferme per il potenziale sviluppo di iperpotassiemia (27). Gli ACE-inibitori e gli inibitori di AT1 perciò sono sicuri nei pazienti con IR lieve-moderata e sono da considerarsi di primo uso negli ipertesi con IR per gli innegabili vantaggi emersi dai vari trials. Il loro benefico effetto deriva dalla combinazione dei diversi meccanismi protettivi rappresentati dall’effetto antiipertensivo, emodinamico, antiproteinurico e da quelli pleiotropici che sostengono il razionale forte per considerali nel trattamento dei pazienti ad alto rischio. E’ necessario però iniziare con dosi minori monitorando la funzione renale e la potassiemia (28). Molti ACE-I sono metabolizzati a livello renale ed epatico, però nei pazienti con IR è preferibile utilizzare come prima dose il 50-75% di quella usuale, se il FG <60 ml, il 25-50% se il FG <30mg. Gli inibitori di AT1 sono metabolizzati a livello epatico e come prima dose si utilizza il 75% di quella usuale se il FG è <30%. Un incremento del 30% della creatininemia è accettabile nei primi 2 mesi (28). Invece, nei pazienti con FG<60 ml o con potassiemia >4.5 di base, bisogna controllare settimanalmente la creatininemia e la potassiemia. In ogni caso ACE-I e Sartani sono da sospendere se dopo 4 mesi il FG è inferiore del 30% rispetto ai valori basali e se la potassiemia raggiunge valori>-5. 5 mg. Gli ACE-I ed i Sartani possono indurre uno scompenso renale acuto, i cui fattori di rischio sono: la stenosi dell’arteria renale, la malattia policistica, la riduzione assoluta o effettiva del volume plasmatico arterioso, l’uso di farmaci antinfiammatori non steroidei o di ciclosporina e la sepsi (29). Interventi di rivascolarizzazione Anche per gli interventi di rivascolarizzazione l’IR rappresenta un ostacolo. Best et al della Mayo Clinic (30) però, studiando un gruppo di 11,187 pazienti rivascolarizzati con PTCA, di cui molti con malattia renale cronica lieve o moderata, dopo un follow-up di 9 mesi, hanno trovato un incremento di mortalità in quelli con IR ma la ristenosi non è responsabile di tale evento. In Gran Bretagna, Zakeri et al (31) hanno valutato le complicazioni postoperatorie dopo bypass aortocoronarico nei pazienti con IR o normale funzione renale . Il rischio di morte postoperatoria di morbilità e di sopravvivenza a medio termine incrementa quando il FG scende sotto i 60 mL. Recentemente il gruppo del Toraxcenter di Rotterdam (32) ha riportato i risultati a 5 anni di pazienti con FG<60 trattati con PTCA ( 69 pazienti) o Bypass aortocoronarico ( 73 pazienti) senza riscontrare differenze significative nella mortalità, accidenti cerebrovascolari o infarto miocardio postoprocedura. Nel gruppo PTCA è stata registrata una maggior necessità di successive rivascolarizzazioni.
Conclusioni. La sindrome cardiorenale è un’entità clinica emergente perché circa il 50-60% dei decessi dei pazienti con IR è secondario a complicazioni cardiovascolari. Infatti, ipertensione arteriosa, coronaropatie, alterazioni del miocardio e del pericardio, calcificazioni cardiache, scompenso cardiaco sono comuni nei pazienti con IR. L’alta prevalenza di ipertensione arteriosa, diabete mellito, dislipidemia, ipotensione durante la dialisi, alterato metabolismo di calcio e fosfati e gli squilibri elettrolitici possono compromettere la funzione cardiaca. Come abbiamo ricordato precedentemente, l’IR è un potente fattore di rischio sia per la comparsa di malattie cardiovascolari sia per l’outcomes avverso per eccessive comorbilità, eccesso di tossicità dei farmaci ed insufficiente uso di terapie utili per nichilismo. Il trattamento delle malattie cardiovascolari nei pazienti con IR però ha numerose problematiche: si rende necessario anzitutto scegliere farmaci meno nefrotossici, aggiustando poi il dosaggio in base alla gravità della disfunzione renale e selezionando la dose di carico e quella di mantenimento con il monitoraggio dei livelli plasmatici. In seguito bisogna riassestare l’efficacia della terapia monitorando la creatininemia e la clearance della creatinina. Perciò è indispensabile depistare precocemente la disfunzione renale in particolare negli anziani, negli ipertesi e nei diabetici, utilizzando preferibilmente la clearance della creatinina o la determinazione del livello di Cistatina C. I reni svolgono un ruolo importante in tutti i pazienti cardiopatici, similmente il cuore ha un ruolo fondamentale in tutti i nefropatici. Molti farmaci usati nella terapia contro le malattie di un sistema possono interferire negativamente sulle funzioni dell'altro. Sfortunatamente i pazienti cardiaci e renali spesso sono seguiti da medici competenti in uno solo dei due sistemi. La conoscenza delle interazioni cardiorenali è fondamentale per tutti i medici che siano interessati alla cura di questi malati. Medici di medicina generale, internisti, nefrologi e cardiologi devono valutare precocemente il declino della funzione renale in particolare per quei pazienti a rischio di scompenso cardiaco per iniziare al più presto una terapia renoprotettiva (2). In particolare, è necessario migliorare la valutazione della IR nei pazienti ospedalizzati per malattie cardiovascolari perché la loro presenza predice un rapido deterioramento della funzione renale. Il legame fra malattia cardiaca e renale è importante se la funzione renale è determinata con i livelli di Cistatina C, la prevalenza di ambedue queste patologie é in continuo aumento nei paesi occidentali compreso il nostro. Esse rappresentano la maggior sfida per il Servizio Sanitario nei prossimi anni (33).
Bibliografia 1. Ravera M Paoletti E Ipertensione arteriosa, dislipidemia e rischio cardiovascolare nella malattia renale cronica Ital Heart J Supp 2004; 5:436-444. 2. Deo R, Fyr CL, Fried LF et al Kidney dysfunction and fatal cardiovascular disease-an association independent of atherosclerotic events: results from the Health, Aging, and Body Composition (Health ABC ) study Am Heart J 2008,155:62-68 3. Deo R, Lin F Vittinghoff E et al Kidney dysfunction and sudden cardiac death among women with coronary heart disease Hypertension 2008; 51:1578-1782 4. Zamboli P, DeNicola L, Minutolo R etal Heart failure in chronic kidney disease: from epidemiology to therapy G Ital Nefrol 2007; 24:574-583 5.McCullough PA Acute coronary syndromes in patients with renal failure Curr Cardiol Rep 2003; 5:266-270 6. Cirillo M, Lanti MP, Menotti A et al Definition of kidney dysfunction as a cardiovascular risk factor: use of urinary albumin escretion and estimated glomerular filtration rate Arch Intern Med 2008; 168: 617-624 7. Filed LF, Shlipak MG, Crump C et al Renal insufficiency as a predictor of cardiovascular outcomes and mortality in elderly individuals J Am Coll Cardiol 2003; 41:1364-1372 8.Herget-Rosenthal S, Bokenkamp A, Hofmann W How to estimate GFR-serum creatinine, serum Cystatin C or equations ? Clin Biochem 2007; 40:153-161 9. Ix JH , Shlipak MG, Chertow GM, Whooley MA Association of Cystatin C with mortality, cardiovascular events, and incident heart failure among persons with coronary heart disease: data from the Heart and Soul Study Circulation 2007; 115:173-179 10. Stigant C, Stevens L, Levin A Nephrology: 4 Strategies for the care of adults with chronic kidney disease CMAJ 2003; 168:1553-1560). 11.Levin A Clinical epidemiology of cardiovascular disease in chronic kidney disease prior to dialysis Semin Dial 2003; 16:101-105 . 12. McCullough PA Jurkovitz CT, Pergola PE et al Independent components of chronic kidney disease as a cardiovascular risk state: results from the Kidney Early Evaluation Program ( KEEP ) Arch Intern Med 2007; 167:1122-1129 13. McCullough PA, Li S, Jurkovitz CT et al CKD and cadiovascular disease in screening high-risk volunteer and general populations:the Kidney Early Evaluation Program ( KEEP ) and National Health and Nutrition Examination Survey ( NHANES ) 1999-2004 Am J Kidney Did 2008; 51 ( Supp 2 ) :S38-45 14. Locatelli F, Marcelli D, Conte F et al Cardiovascular disease in chronic renal failure: the challange continues. Registro Lombardo Dialisi e Trapianto Nephrol Dial Transplant 2000; 15 Supp 5:69-80. 15. Bibbins-Domingo K. Lin F, Vittionghoff E et al Renal insufficiency as an independent predictor of mortality among women with heart failure J Am Coll Cardiol 2004, 44:1593-1600 16. Anavekar NS, McMurray JJ, Velasquez EJ et al Relation between renal dysfunction and cardiovascular outcomes after myocardial infarction New Eng J Med 2004; 351: 1285-1295 17. Mcallister FA , Ezekowitz J, Tonelli M et al Prognostic and therapeutic implications from a prospective cohort study Circulation 2004; 109:1004-1009 18. McCullough PA Contrast-induced acute kidney iniury J Am Coll Cardiol 2008; 51:2197-1428 19. Reddan DN Szczech L, Bhapkar MV et al Renal function, concomitant medication use and outcomes following acute coronary syndromes Nephrol Dial Transplant 2005; 20:2105-2112 20. Ezekowitz J , McAlister FA, Humphries KH et al The association among renal insufficiency, pharmacotherapy, and outcomes in 6,427 patients with heart failure and coronary artery disease J Am Coll Cardiol 2004; 44:1587-1592 21. Berger AK ,. Duvsl S, Krumholz HM, et al Aspirin, beta-bloker, and angiotensin-converting enzyme inhibitor therapy in patients with end-stage renal disease and an acute myocardial infarction J Am oll Cardiol 2003; 42:201-208 22. Tonelli M, Isles C, Curhan GC et al Effect of pravastatin on cardiovascular events in people with chronic kidney disease Circulation 2004; 110:1557-1563 23. Sherperd J, Kastelein JJP, Bitter V et al Intensive lipid lowering with atorvastatin in patients with coronary heart disease and chronic kidney disease The TNT ( Treating to New Tagets) Study J Am Coll Cardiol 2008; 51:1448-1454 24. Mann JE, Gerstein HC, Poque J et al Renal insufficiency as a predictor of cardiovascular outcomes and the impact of ramipril: the HOPE randomized trial Ann Intern Med 2001; 134:629-636 25. Balamuthusamy S, Srinivasan L, Verma M et al Renin angiotensin system blockade and cardiovascular outcomes in patients with chronic kidney disease and proteinuria: a meta-analysis Am Heart J 2008; 155:791-805 26. Lewis EJ , Hunsicker LG, Clarke WR et al Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes New Eng J Med 2001, 345:851-860 27. Kunz R, Friedrich C, Wolbers M, Mann JF Meta-analysis : effect of monotherapy and combination therapy with inhibitors of the renin angiotensin system on proteinuria in renal disease Ann Intern Med 2008; 148:30-48 28. Matchatr DB, McCrory DC, Orlando LA et al Systemic review:comparative effectiveness of angiotensin-converting enzyme inhibitors and angiotension II receptor blockers for treating essential hypertension Ann Intern Med 2008; 148:16-29 29. Palmer B F Renal dysfunction complicating the treatment of hypertension N Engl J Med 2002; 347:1256-1261. 30. Best PJ, Berger PB, Davis BR et al Impact of mild or moderate chronic kidney disease on the frequency of restenosis: results from the PRESTO trial J Am Coll Cardiol 2004; 44:1786-1791 31. Zakeri R, Freemantle N, Barnett V et al Relation between mild renal dysfunction and outcomes after coronary artery bypass grafting Circulation 2005; 112: ( Supp 9)1270-1275 32. Aoki J, Ong AT, Hoye A et al Five year clinical effect of coronary stenting an coronary artery bypass grafting in renal insufficient patients with multivessel coronary artery disease; insights from ARTS trial Eur Heart J 2005; 26:14881493 33. McClellan WM, Langston RD, Presley R Medicare patients with cardiovascular disease have a high prevalence of chronic kidney disease and a high rate of progression to end-stage renal disease J Am Soc Nephrol 2004; 15:1912-1919 |