|
Cuore ed Insufficienza Cerebrovascolare
G. D’Angelo, A. Carbone, E. Vicinanza, P. Bottiglieri, M. De Cristofaro, M. Sonderegger, M. Punzi Dipartimento Cardiovascolare - ASL SA 2
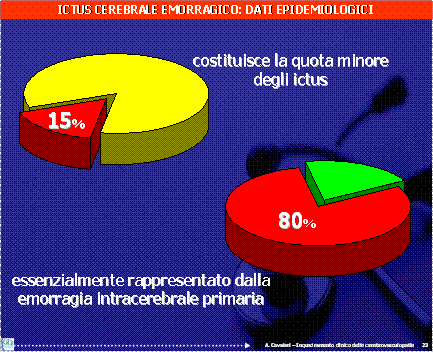
L’ictus rappresenta la terza causa di morte in Italia dopo le malattie cardiovascolari e le neoplasie e si avvia ad essere la seconda in rapporto all’allungamento della vita media: si pensi che l’aspettativa di vita in Italia è di 78 anni per l’uomo e di 64 anni per le donne. L’indice di vecchiaia, cioè il rapporto tra la popolazione con 65 anni e oltre e quella con meno di 15 anni, è risultato pari al 137,7 per cento nel 2005 con costante aumento rispetto agli anni precedenti. Il tasso di prevalenza di ictus nella popolazione anziana ( età 65-84 anni ) italiana è di circa il 6.5%, più alto negli uomini che nelle donne ( 7.4% versus 5.9% ) ; la prevalenza cresce in modo cospicuo negli ultra ottantacinquenni raggiungendo valori superiori al 10% con incidenza tra 20‰ e 35‰ circa, alta preponderanza di ictus ischemici e prognosi peggiore in termini di mortalità e di complicanze rispetto ai soggetti più giovani (1). L’ictus ischemico rappresenta la forma più frequente di ictus (80% circa), mentre le emorragie intraparenchimali riguardano il 15%-20% e le emorragie subaracnoidee il 3% circa.
� Ogni anno in Italia si verificano circa 200.000 casi di ictus, di cui l’80% sono nuovi episodi � L’incidenza media annuale in Italia, corretta per età, è di 220 casi/100.000/anno � A tutto il 2001 i sopravvissuti ad ictus in Italia sono circa 913.000; ad oggi superano il milione e di questi oltre 1/3 risultano totalmente inabili � Attualmente il numero di decessi per ictus rappresenta il 10-12% del numero globale di decessi ed è pari a 6 milioni nel mondo; nel 2020 il numero raddoppierà. Siamo quindi di fronte ad una patologia con rilevante impatto individuale, familiare e sociosanitario, con costi assistenziali elevati e frequentemente durevoli; di qui la necessità e la opportunità di incentivare politiche sanitarie di intervento per la prevenzione primaria e per la gestione della fase acuta dell’ictus, nella consapevolezza che questi costi sono inferiori a quelli indotti dalle cure riabilitative degli esiti invalidanti e dalle terapie nella fase di cronicizzazione. Partendo da queste considerazioni si comprende facilmente il ruolo importante che la cardiologia può e deve svolgere nella insufficienza cerebrovascolare, soprattutto nell’ictus ischemico, nel quale vanno considerate le possibili fonti cardioemboliche, che possiamo suddividere in fonti ad elevato rischio e a basso-medio rischio:
Ad elevato rischio: � FA non isolata � Protesi valvolare meccanica � Stenosi mitralica con FA � Trombosi dell’atrio e/o dell’auricola sn � Sindrome del nodo del seno � IMA recente (<4 sett.) � Trombo ventricolare sn � Mixoma atriale � Endocardite infettiva � Cardiomiopatia dilatativa � Acinesia di parete del ventricolo sn
A basso-medio rischio: � Prolasso della mitrale � Calcificazione dell’anulus mitralico � Stenosi mitralica senza FA � Forame ovale pervio � Aneurisma del setto interatriale � Ecocontrasto spontaneo in atrio sn � Stenosi aortica calcifica � Flutter atriale � FA isolata � Protesi valvolare biologica � Endocardite trombotica non batterica � Scompanso cardiaco congestizio � Ipocinesia segmentaria del ventricolo sn � IMA non recente (> 4 settimane, < 6 mesi) In tutte queste condizioni lo studio ecocardiografico appare la tecnica diagnostica cardiologica di riferimento( 2). Potrà essere effettuato per via transtoracica (TTE) e per via transesofagea (TEE), tenendo presente che l’approccio mediante TEE risulta insostituibile per la individuazione e lo studio di alcune fonti cardioemboliche
Il rilievo in un paziente della presenza di una fonte cardioembolica potrà indurre l’impiego di terapia anticoagulante o antiaggregante, terapia indispensabile in caso di storia clinica di precedenti eventi cerebrovascolari. Una menzione particolare merita la ricerca di placche aortiche a livello dell’aorta toracica, in particolare del tratto situato a livello dell’arco, la cui presenza, documentabile mediante ecocardiografica TEE, può essere indicativa di uno stato di ipercoagulabilità. Infatti lo studio APRIS (6) ( Aortic Plaque and Risk of Ischemic Stroke) ha confermato la predittività per eventi cerebrovascolari acuti delle placche aortiche complesse rilevate in corso di TEE ( 3-4-5), dimostrando altresì che nei pazienti con placche aortiche complesse all’arco ed ictus, esisteva uno stato di ipercoagulabilità espresso dall’aumento significativo nel sangue dei livelli di fibrinogenemia e del frammento protrombinico F 1.2, prodotto della conversione di protrombina in trombina, sostanza che rappresenta a sua volta la via terminale sia intrinseca che estrinseca del meccanismo di coagulazione. Numerosi sono i fattori di rischio (1) connessi alla comparsa di cerebrovasculopatie:
- Immodificabili: età, sesso e predisposizione familiare - Modificabili così suddivisi: FATTORI DI RISCHIO MODIFICABILI BEN DOCUMENTATI - ipertensione arteriosa - alcune cardiopatie (in particolare fibrillazione atriale) - Diabete Mellito - Iperomocisteinemia - Ipertrofia Ventricolare sinistra - Stenosi della carotide - Fumo di sigaretta - Eccessivo consumo di alcool - Ridotta attività fisica - Dieta Altri fattori che probabilmente aumentano il rischio di ictus Al momento non Completamente documentati come fattori indipendenti di rischio: - Dislipidemia - Obesità - Sindrome Metabolica - Alcune Cardiopatie (Forame ovale pervio,aneurisma settale) - Placche dell’arco aortico - Uso di contraccettivi orali - Terapia Ormonale sostitutiva - Emicrania - Anticorpi antifosfolipidi - Fattori dell’emostasi - Infezioni - Uso di Droghe - Inquinamento atmosferico Come si può ben comprendere, numerosi fattori di rischio per cerebrovasculopatie sono comuni a quelli riconosciuti quali fattori di rischio per cardiovascolari, verso i quali da lungo tempo il mondo cardiologico ha intrapreso una energica azione di prevenzione fatta di interventi farmacologici ma soprattutto di induzione al cambiamento dello stile di vita, con risultati consistenti e confortanti: in USA nel periodo 1980-2000 si è avuto una progressiva e consistente riduzione di mortalità per malattia coronarica pari al 50% , riferibile per il 54% alla riduzione dei fattori di rischio (7). Sempre in USA nel decennio 1994-2004 si è registrato una riduzione del 24% di mortalità per ictus (8). Fin qui il ruolo del cuore e del cardiologo nella prevenzione dell’ictus. La cooperazione tra specialista cardiovascolare e specialista neurologo trova uno spazio ancora più ampio ed importante quando si decide di affrontare la fase acuta dello stroke, in particolare della forma ischemica. E’ oramai conoscenza diffusa ma scarsamente applicata la opportunità e necessità di terapia trombolitica in pazienti affetti da ictus ischemico, che giungono all’osservazione in Pronto Soccorso entro le 3 ore dall’esordio dei sintomi; anzi recentissimamente sulla prestigiosa rivista “The Lancet“ è comparso un articolo che riporta i primi risultati dello studio osservazionale SITS-ISRT ( Safe Implementation of Treatments in Stroke- Intrnational Stroke Treatment Registry ) che dimostra la possibilità di estendere il trattamento con Alteplase sino a 4.5 ore (9). Questo studio nasce da esigenze simili a quelle già verificate dal mondo cardiologica attraverso studi analoghi sulla possibilità di ampliare il numero dei pazienti affetti da IMA con ST sopraslivellato da trattare con trombolisi, quando non eleggibili a rivascolarizzazione meccanica ( PTCA ± stent ) ; attualmente la trombolisi è consigliata entro 6 ore dall’esordio dei sintomi con possibilità sino a 12 ore. Dunque sul piano organizzativo l’emergenza nei pazienti affetti da SCA è sovrapponibile a quella da realizzare nei pazienti affetti da ictus: il tempo è muscolo per il cuore di pazienti con SCA, è cervello per i pazienti con ictus. E’ evidente che la rete cardiologica deve diventare rete cardiovascolare e la tempestività di trattamento sollecitata e richiesta per pazienti con SCA deve essere realizzata parimenti per i malati colpiti da ictus, nella consapevolezza che mentre nel primo caso si può realizzare una preziosa anticipazione temporale della terapia farmacologica effettuabile già a domicilio, nel secondo caso dovrà tendere a ridurre i tempi decisionali. Innovazioni organizzative per velocizzare il trattamento del paziente con ictus nella fase acuta sono state sperimentate negli ultimi mesi: 1) consulto telefonico tra medici del dipartimento di emergenza e neurologi esperti di Stroke al fine di iniziare quanto prima la terapia trombolitica; questa modalità organizzativa è stata messa a confronto con quella più costosa del teleconsulto: nessuna differenza relativamente alla frequenza di terapia trombolitica (28% vs. 23% ), di outcomes a 90 giorni, di mortalità, di frequenza di complicanza emorragica (7% vs. 8%). Il tempo decisionale è risultato più lungo nel gruppo di pazienti valutati mediante teleconsulto (65 vs. 55 minutes) (10) 2) impiego in ambulanza di infermieri opportunamente formati per la valutazione di pazienti con sospetto ictus, così da ridurre sia i tempi di chiamata del medico “ call to doctor “ sia i tempi di accesso al medico “ door to doctor “ (11)
Un accenno va fatto a terapie interventistiche nella fase acuta dell’ictus. Sono da considerarsi ancora terapie “ elettive “, da affidare a mani di esperti in interventistica vascolare, al momento praticabili a pazienti con ictus nei quali vi è controindicazione alla trombolisi o fallimento della stessa. Lo studio MERCI (Mechanical Embolus Removal in Cerebral Ischemia) ha dimostrato fattibilità ed efficacia della embolectomia meccanica nel paziente con ictus ischemico (12); i risultati finali qui di seguito rappresentati nella tabella 4 del lavoro di Wade S. Smith e coll ( 12) dimostrano la significativa differenza in outcome e mortalità tra pazienti ricanalizzati e non. Table 4. Neurological Outcomes at 90 Days
D’altra parte la positività del risultato meccanico di embolectomia nel vaso cerebrale ostruito dipende anche dal tipo di catetere utilizzato (13). Infine “ il cuore “ va protetto, studiato e sorvegliato anche nella fase cronica della vasculopatia cerebrale perché non è infrequente la comparsa a breve distanza da un episodio di SCA di un evento ischemico cerebrale acuto. Inoltre ancora aperta alla discussione è l’impiego delle statine. Le linee guida pubblicate nel Luglio 2008 dal NICE ( National Institute for Health and Clinical Excellence ) chiariscono che sono ancora pochi e non del tutto chiare le dimostrazioni relative alla necessità di introdurre sistematicamente le statine nella terapia del paziente colpito da ictus, mentre risulta evidente l’effetto negativo della interruzione delle stesse post-stroke (14). Infine relativamente all’impiego degli antiaggreganti nello stroke, lo studio PRoFESS ha dimostrato definitivamente la non superiorità della terapia con duplice antiaggregante, aspirina + dipiridamolo versus il clopidogrel nella prevenzione del recurrent stroke; l’associazione sembra incrementare il numero di stroke emorragici (15).
Per concludere possiamo affermare che le relazioni tra apparato cardiovascolare e funzioni cerebrali sono estremamente complesse e bidirezionali. Pertanto è errato cercare di stabilire una gerarchia tra questi due importantissimi sistemi.
Bibliografia
1) SPREAD V Edizione (2008) 2) Eleni Doufekias, MD et al. : Cardiogenic and Aortogenic Brain Embolism – JACC 2008; 51: 1049-1059 3) Amareno P. et al.: Atherosclerotic disease of the aortic arch and the risk of ischemic stroke – N Engl J Med 1994; 331: 1474-1479 4) D’Angelo G. e coll. Symposium Rotterdam 1995, June 21-23 abs. 5) Di Tullio MR et al: Aortic atheroma morphology and the risk of ischemic stroke in a multiethnic population – Am Heart J 2000; 139; 329-336 6) Marco R. Di Tullio et al: Aortic Atherosclerosis, Hypercoagulability, and Stroke- The APRIS Study – JACC 2008; 52: 855-861 7) Earl S. Ford M.D. et al: Explaining the decrease in U.S. deaths from coronary disease, 1980-2000: The N.Eng. J. M. June 7,2007, vol 356: 2388-2398 8) Rosamond W, et al: Heart disease and stroke statistics-2007 update: a report from the American Heart Association Statistics Committee and Stroke Statistics- Circulation 2007; 115: e69-e171 9) Nils Wahlgren et al: Trrombolysis with alteplase 3-2.5 h after acute ischemic stroke(SITS-ISTR): an observational study- The Lancet 15 Settembre 2008:10.1016 10) John A. Marx MD: Telemedicine for stroke patients- Journal Emergency Medicine Ag.2008 11) Ian Mosley M Bus et al: The impact of ambulance practice on acute stroke care- Stroke 2007; 38:2765-2770 12) Wade S. Smith MD, PhD et al: Mechanical Thrombectomiy for acute Ischemic Stroke: Final results of the Multi Merci Trial- Stroke 2008; 39:1205 13) Caspar Brekenfeld, MD et al: Mechanical TromboembolectomY for acute Ischemic Stroke: Comparison of the cath trombectomy device and Merci Retriever in vivo- Stroke 2008;39:1213 14) NICE JULY 2008 15) Sacco RL et al. for the PRoFESS Study Group. Aspirin and extended-release dipyridamole versus clopidogrel for recurrent stroke. N Engl J Med 2008 Aug |
|||||||||||||||||||||||||||||||||||||