|
STENOSI MITRALICA: COME RICONOSCERLA, COME VALUTARLA , COME TRATTARLA
Pio Caso, Sergio Severino, Roberta Ancona, Emilio Attena, Luigi Nunziata, Saverio Ambrosino, Meredyth Vanessa Betancourt C., Raffaele Calabrò
U.O.S. Diagnostica Non Invasiva-Dipartimento di Cardiologia Monaldi Napoli
Stenosi MitralicaNella maggior parte dei casi la Stenosi Mitralica (SM) è causata dalla malattia reumatica (MR). La sua incidenza è in costante declino nei paesi industrializzati, grazie alla diffusione della terapia antibiotica. Invece essa è ancora molto diffusa nei paesi in via di sviluppo e da tali aree per la continua emigrazione di stranieri in Italia si hanno nuovi casi. In questi paesi in via di sviluppo, la MR è soprattutto diffusa tra le giovani donne, dove può dare la prima manifestazione di sé durante la gravidanza: condizione in cui il volume di sangue circolante aumenta considerevolmente per la presenza del feto. Le altre cause di stenosi mitralica sono molto rare. La SM congenita è rara. Una forma rara di SM è quella caratterizzata da massiva calcificazione anulare della valvola mitrale. Questo processo è presente più frequentemente nei soggetti anziani e determina SM limitando i movimenti dei lembi valvolari. Altre cause sono il mixoma atriale, un grosso trombo “a palla “ in atrio sinistro, endocardite infettiva ed alcune malattie ereditarie. La valvola mitralica è costituita da vari elementi, un annulus fibroso, due lembi valvolari (anteromediale e posterolaterale), corde tendinee e due muscoli papillari (posteromediale ed anterolaterale). Nel soggetto normale l’area valvolare è compresa tra i 4-5 cm2, la stenosi mitralica è la riduzione dell’area valvolare mitralica per interessamento dei lembi valvolari, delle commissure o delle corde tendinee con ostruzione al flusso del sangue nel passaggio dall’atrio al ventricolo sinistro1,2. Come riconoscere una stenosi mitralica La visita clinica resta sempre il primo step diagnostico, con essa si valutano i sintomi ed i segni obiettivi delle cardiopatie. I sintomi soggettivi sono correlabili con la gravità della stenosi, anche se alcuni pazienti minimizzano i sintomi, mentre altri li esaltano. Quando l’ostruzione valvolare è lieve, un paziente con SM può essere asintomatico a riposo e presentare dispnea durante sforzo, per aumento della pressione in atrio sinistro. Con l’aumento dell’ostruzione valvolare mitralica, la dispnea compare anche a riposo. Quando l’ostruzione valvolare progredisce, il paziente comincia a lamentare ortopnea e dispnea parossistica notturna, dovuta a ridistribuzione del sangue nel torace all’assunzione della posizione supina. Con l’instaurarsi di una SM grave e con l’aumento delle resistenze vascolari polmonari si può instaurare il quadro dell’edema polmonare acuto. Altro sintomo frequente è l’emoftoe, che può essere dovuta a diverse cause ma è in genere provocata dalla rottura dei piccoli vasi broncopolmonari per aumento della pressione venosa polmonare. L’astenia e la diminuzione della resistenza alla fatica sono in rapporto alla ridotta gittata cardiaca ed alla conseguente deplezione muscolare. ; le palpitazioni sono un sintomo frequente nei pazienti con SM e sono dovute alla comparsa di extrasistolia atriale o fibrillazione/flutter atriale parossistici, complicanze frequenti della SM. Un’altra complicanza frequente è l’embolia sistemica, con ictus, occlusione delle arterie periferiche, occlusione della biforcazione aortica, infarto viscerale o infarto intestinale. L’aumento dell’età del paziente, la fibrillazione atriale e l’incremento delle dimensioni dell’atrio sinistro determinano un aumento dell’incidenza di embolie sistemiche. Anche i segni obiettivi sono in relazione all’ entità della stenosi. Un paziente con SM lieve può presentare un esame obiettivo normale o la presenza di un I tono di aumentata intensità e di un soffio presistolico. Nei pazienti sintomatici, i rilievi obiettivi sono più evidenti e un accurato esame fisico del paziente può portare a formulare una corretta diagnosi. All’ ispezione si può osservare la facies mitralica, non frequente, caratterizzata da cianosi più o meno intensa agli zigomi, orecchie e naso. Alla palpazione l’itto della punta può essere normale, mentre si può palpare un impulso sistolico sulla linea parasternale sinistra o sull’epigastrio se il ventricolo destro è ipertrofico e/o dilatato. All’ascoltazione si può rilevare un I tono aumentato per la rigidità dei lembi e per l’ampia escursione della valvola semiaperta in telediastole. Lo schiocco d’apertura (SA) della mitrale è un rumore ad alta frequenza che si ascolta dopo il II tono in protodiastole, quanto più breve è l’intervallo tra II tono e SA, tanto più importante è la stenosi. Sebbene lo SA sia presente in quasi tutti i pazienti con SM, può essere assente quando i lembi mitralici sono molto rigidi, fibrotici e calcifici. Un soffio diastolico a bassa frequenza segue lo SA ed è meglio auscultato dalla campana del fonendoscopio. Il soffio è a bassa frequenza, quasi un rullio e in decrescendo. In genere più la SM è grave, più il soffio è di lunga durata. Il soffio presenta un rinforzo presistolico, anche in presenza di fibrillazione atriale. In questa condizione un rinforzo presistolico è dovuto al restringimento dell’orifizio mitralico che avviene dopo la sistole ventricolare prima della chiusura completa della valvola e alla componente mitralica del I tono. Nei casi più gravi eventuali reperti ascoltatori possono essere: soffio diastolico di Graham-Steel (soffio diastolico in decrescendo ad alta frequenza dovuto ad in sufficienza polmonare da ipertensione arteriosa polmonare grave); soffio sistolico polmonare (determinato da dilatazione dell’arteria polmonare e dalla ipertrofia del ventricolo destro); soffio sistolico puntale (soffio olosistolico dolce all’apice suggerisce la contemporanea presenza di insufficienza mitralica) e soffio sistolico tricuspidale (indice di insufficienza tricuspidale, aumenta con l’inspirazione)3.
Come valutare una stenosi mitralica Per valutare la gravità della SM, oltre all’obiettività clinica, si tengono in considerazione parametri emodinamici ricavabili dall’Ecocardiogramma e rappresentati da: a) il gradiente medio transvalvolare; b) la pressione sistolica dell'arteria polmonare (PAPS) e c) l’area valvolare (AVM). Distinguiamo pertanto una SM : lieve (AVM > 1.5 cm2, gradiente medio inferiore a 5 mmHg, o PAPS= 30 mmHg), moderata (AVM = 1.0 - 1.5 cm2, gradiente medio 5 - 10 mmHg e PAPS =30-50 mmHg) severa (AVM < 1 cm2; gradiente medio > 10 mmHg; PAPS > 50 mmHg.4 Per una migliore valutazione morfologica della valvola mitrale viene utilizzato lo Score di Wilkins, che valuta: mobilità e spessore dei lembi valvolari, spessore dell’apparato sottovalvolare e presenza di calcificazioni. Si assegna un punteggio crescente, da 1 a 4 per ciascun parametro valutato e la somma dei valori ottenuti (minimo: 4 e massimo: 16) esprime il grado di compromissione valvolare. Ad un elevato score corrisponde sia una maggiore gravità della stenosi sia un risultato non ottimale dell’eventuale procedura riparativa valvolare. (Tab. I)
Tabella I. Score di Wilkins
L’area valvolare mitralica può essere stimata utilizzando diversi metodi: quello della planimetria, del pressure-half-time (PHT), dell’equazione di continuità, o della convergenza del flusso. La planimetria della valvola mitrale è un metodo molto attendibile quando c’è una buona visualizzazione delle strutture valvolari. Il PHT è un metodo semplice, ma la sua accuratezza nella determinazione dell’area valvolare è controversa nel cambiamento delle condizioni emodinamiche. Il metodo dell’equazione di continuità è più accurato del PHT durante gli stati di alto flusso, ed è il metodo preferito per determinare l’effettiva area valvolare mitralica. La convergenza del flusso è un nuovo metodo per calcolare l’area valvolare mitralica attraverso il rapporto tra il flusso massimale stimato in diastole e la velocità massimale transmitralica diastolica. L’Ecostress gioca un ruolo importante nella valutazione del paziente asintomatico con stenosi mitralica severa cioè quei pazienti asintomatici a riposo, che con lo sforzo manifestano dispnea per un marcato aumento del gradiente medio (>15 mmHg) e della PAPS. Inoltre esso è utile nei pazienti sintomatici con SM moderata ed è anche un importante strumento per il follow-up emodinamico dei pazienti dopo commissurotomia5. L’Ecocardiografia transesofagea (ETE) consente di visualizzare meglio rispetto all’ ecocardiografia transtoracica (TTE) le alterazioni morfologiche dell’apparato valvolare e sotto- valvolare, l’eventuale presenza di trombi sul setto interatriale o sul tetto dell’atrio sinistro, l’auricola sinistra e le velocità Doppler auricolari, l’ecocontrasto spontaneo e l’eventuale grado di insufficienza mitralica (IM). Lo Score di Wilkins può essere valutato anche con l’ETE6.
Come trattare una stenosi mitralica La procedura di valvuloplastica mitralica percutanea (VPM), dilatazione della valvola stenotica con catetere a palloncino, è uno dei molti metodi per il trattamento della stenosi mitralica sintomatica; i metodi alternativi sono: terapia medica, commissurotomia chirurgica e sostituzione della valvola mitrale. Quando le condizioni anatomo-funzionali dell’apparato valvolare lo consentono, la terapia conservativa (VPM, o la commissurotomia chirurgica a cielo chiuso o aperto) è più indicata ed economica della terapia sostitutiva; in genere la VPM è preferita nei paesi industrializzati, mentre la commissurotomia chirurgica lo è nei paesi in via di sviluppo per i minori costi che essa comporta. Trial randomizzati hanno dimostrato che i risultati della valvuloplastica percutanea e della commissurotomia chirurgica a cielo chiuso sono simili7,8,9. La decisione terapeutica nella stenosi mitralica viene presa in seguito allo Score di Wilkins, pertanto per uno Score < 8 ( in assenza o lieve insufficienza mitralica ) vi è indicazione alla valvuloplastica, invece per pazienti con Score > 8 alla chirurgia sostitutiva. La valvuloplastica mitralica percutanea (VPM) è una tecnica di dilatazione della valvola mitrale stenotica con catetere a palloncino (attualmente il più usato è quello di Inoue) che introdotto per via femorale e dopo la settostomia viene posizionato tra le commissure ;il gonfiaggio determina la separazione (“splitting”) con aumento immediato dell’area mitralica e conseguente riduzione del gradiente atrio-ventricolare
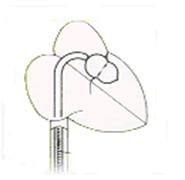
Figura SEQ Figura \* ARABIC 1 Catetere di Inoue
La VPM rappresenta la procedura di scelta nei casi in cui ve ne sia indicazione (vedi linee guida attuali riportate nelle conclusioni) e in assenza di controindicazioni (Tab.II).
Tabella II. Controindicazioni alla VPM
Controindicazioni assolute alla VPM sono l’insufficienza valvolare mitralica di grado moderato-severo e la presenza di un trombo mobile in atrio sinistro o sul setto interatriale. In generale nei pazienti in cui la valvola ha un elevato score di Wilkins ( in particolare se sono presenti calcificazioni, fibrosi-retrazione e fusione dell’apparato sottovalvolare) è consigliabile ricorrere alla sostituzione valvolare. La VPM è consigliabile anche in una serie di pazienti considerati “non ideali” quali : - anziani con elevata comorbilità - coesistenza di patologie sistemiche/respiratorie, - grave ipertensione polmonare, - donne in gravidanza - coinvolgimento di altra valvola
Infatti, in questi pazienti pur in presenza di uno score elevato, la procedura potrà essere eseguita anche se il risultato atteso sarà subottimale, avendo essa stessa l’obiettivo di ridurre i sintomi. Nei pazienti con ipertensione polmonare poi, in cui è più alto il rischio chirurgico, la VPM ha risultati che sono superiori a quelli della chirurgia. Le donne in gravidanza con severa insufficienza cardiaca dovuta a stenosi mitralica presentano un’alta morbilità materna e uno sfavorevole effetto sul feto10. La VPM, rispetto alla commissurotomia chirurgica a cielo aperto, ha dimostrato minori complicanze fetali ed una più bassa mortalità neonatale e fetale11; il rischio dovuto a radiazioni potrà essere ridotto grazie ad una parziale schermatura dell’addome ed all’assistenza eco in sala di emodinamica durante la VPM. I risultati a lungo termine in donne gravide sono ottimi12.
Assistenza ecocardiografica durante valvuloplastica L’assistenza ecocardiografica in sala di emodinamica è risultata utile : - come guida alla puntura transettale , - per posizionare correttamente il pallone a livello delle commissure, - per valutare il risultato immediato, -per il rilievo di eventuali complicanze. L’assistenza ecocardiografica è praticata normalmente con ecocardiografia transtoracica,e solo in determinate condizioni con ecocardiografia transesofagea (ETE). In realtà l’ETE è poco usata durante VPM per le ovvie difficoltà create da una procedura semi-invasiva in un paziente in decubito supino sul tavolo di emodinamica. L’ecocardiografia può rilevare, quali evidenze di buon risultato, la maggiore mobilità dei lembi, la riduzione del gradiente medio, le variazioni in M-mode color con scomparsa dell’“aliasing” in mesodiastole. Tuttavia il calcolo dell’area con il PHT e della pressione polmonare immediatamente dopo la procedura, in sala di emodinamica, non è affidabile a causa della non applicabilità di tale metodo in presenza di improvvise variazioni di compliance
Complicanze VPM Le complicanze gravi quali morte (< 1%) e tamponamento (1-4%) sono rare; più frequente il difetto interatriale residuo (< 5% con tecnica di Inoue) e l’ insufficienza mitralica superiore a lieve ( varia nelle casistiche tra il 2 e il 10%). L’insufficienza mitralica in particolare si verifica quando il pallone durante il gonfiaggio è posto troppo in basso tra le corde fuse dell’imbuto mitralico o per lacerazione paracommissurale di una commissura o di un lembo (possibile se sono presenti calcificazioni). In questi casi i pazienti vengono indirizzati al cardiochirurgo per la sostituzione valvolare. Il difetto interatriale iatrogeno (creato dalla puntura transettale) tende a chiudersi spontaneamente nel tempo; la sua presenza è legata al persistere di alte pressioni in atrio sinistro.
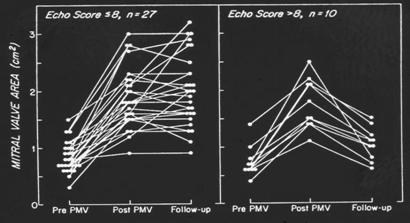
Risultati I risultati immediati della VPM sono simili a quellli della commissurotomia a cielo chiuso con una percentuale di pazienti tra l’80-95% che hanno un risultato ottimale immediato (definito come un incremento dell’AVM ≥1.5 cm² in assenza di complicazioni)13,14. La commissurotomia a cielo aperto, nei paesi industrializzati, permette una correzione chirurgica ottimale nei casi in cui la VPM è di incerto risultato : con tale procedura è possibile la rimozione di trombi, l’incisione delle commissure, l’incisione delle fusioni cordali, la divisione dei papillari e l’asportazione del calcio. La mortalità operatoria varia tra l’1 ed il 3%. Non ci sono differenze significative nei risultati emodinamici o nelle eventuali complicanze tra la VPM e la chirurgia così come sul miglioramento clinico e la ripresa dell’attività motoria. Follow-up a lungo termine (3-7 anni) confermano il vantaggio sia emodinamico che sintomatico della VPM rispetto alla commisurotomia a cielo chiuso.15,16 I risultati immediati, le complicanze in acuto, e i risultati a lungo termine dipendono da numerosi fattori. Oltre che dall’esperienza del centro ove viene eseguito l’intervento, fattori importanti sono sicuramente l’età, la classe NYHA, la severità della stenosi, la pressione telediastolica in ventricolo sinistro, la frazione di eiezione, la pressione d’incuneamento in arteria polmonare. La morfologia dell’apparato sottovalvolare mitralico è il fattore determinante il risultato a breve e lungo termine della VPM : valvole con score di Wikins > 8 calcificazioni valvolari, lembi fibrotici e rigidi con ridotta escursione sisto-diastolica e la compromissione sottovalvolare, hanno una maggiore probabilità di sviluppare complicanze in acuto e nel follow-up presentano una maggiore percentuale di restenosi.14,17,18,19,20 (fig 2, fig 3 e fig 4) La nostra esperienza conferma i dati precedenti; infatti, dei 193 pazienti studiati (111 sottoposti a VPM e 82 sottoposti a commissurotomia, con caratteristiche cliniche e morfologiche valvolari sovrapponibili) i risultati immediati ed a lungo termine e le complicanze di entrambe le procedure sono sovrapponibili21,22 .
La restenosi Si definisce restenosi la perdita del 50% del risultato ottenuto con la VPM e/o la riduzione dell’AVM a meno di 1.5 cm2. La restenosi mitralica dopo VPM in pazienti di media età occorre tra il 2 e il 10% (con follow-up medio di 37 mesi), e in pazienti più anziani sale al 22% (con follow-up di 13 mesi)23,24. Il parametro associato alla restenosi secondo Thomas et al.25, è lo score elevato nonché la differente modalità di separazione (splitting) delle commissure :nei pazienti con score alto lo “stretching” avviene sulla valvola e più frequentemente si determina la restenosi.Tuttavia anche in caso di restenosi si può riproporre una nuova VPM. Incoraggianti risultati sono stati ottenuti da Iung et al.26:in 53 pazienti con diagnosi di restenosi si è ottenuta nella quasi totalità dei casi il raddoppio dell’area mitralica ed una buona sopravvivenza a 5 anni.
Follow-up I parametri da seguire nei pazienti sottoposti a valvuloplastica sono: 1) area mitralica; 2) gradiente medio; 3) stima dell’insufficienza mitralica residua; 4) pressione polmonare; 5) difetto interatriale residuo (nel follow-up di valvuloplastica mitralica) . Il controllo ecocardiografico nei pazienti sottoposti a valvuloplastica percutanea andrebbe praticato 1 volta all’anno in caso di risultato ottimale e ogni sei mesi nei pazienti con risultato definibile subottimale.
Figura. 4 Variazione dell’area mitralica dopo valvuloplastica in paziente con score <8 e >8
Conclusioni La VPM è una tecnica ormai consolidata con indicazioni di Classe I nei pazienti con stenosi mitralica severa e morfologia favorevole, alternativa alla chirurgia (riparativa e sostitutiva). I risultati sono molto soddisfacenti e duraturi, con l’indubbio vantaggio di evitare trauma psicologico e cicatrice chirurgica nonché di ridurre la degenza ospedalieri ed i costi.
Secondo le attuali linee guida 4, pubblicate in Agosto 2006 su JACC, la VPM è indicata in :
CLASSE I · pazienti sintomatici ( classe NYHA II, III, IV) che abbiano una SM moderata o severa con basso score di Wilkins (< 8,3) e non presentino evidenza di trombi in atrio sinistro o rigurgito mitralico da moderato a severo (livello di evidenza: A). · pazienti asintomatici con SM moderata o severa ed anatomia favorevole( score di Wilkins <8,3) che abbiano alte pressioni polmonari (> di 50 mmHg a riposo e > 60 mmHg con l’esercizio) in assenza di trombi in atrio sinistro o rigurgito mitralico da moderato a severo. (livello di evidenza C)
CLASSE IIA · pazienti con SM moderata o severa con valvola calcifica e lembi ipomobili, in classe NYHA III-IV e non sono candidati alla terapia chirurgica o sono ad alto rischio chirurgico (livello di evidenza C). Classe IIB · pazienti con SM moderata o severa con anatomia valvolare favorevole alla VPM che hanno fibrillazione atriale di recente insorgenza in assenza di trombi atriali e di rigurgito mitralico moderato o severo. (livello di evidenza C). · pazienti sintomatici con area valvolare >1,5 cm2 ma con parametri di severo impegno emodinamico (PAPS > 60 mmHg, PVWP ≥ 25 mmHg o gradiente medio > 15 mmHg durante l’esercizio) (livello di evidenza C). · pazienti con stenosi moderata o severa che hanno una valvola calcifica e rigida e sono in classe NYHA III, IV (livello di evidenza C).
CLASSE III · pazienti con stenosi lieve (livello di evidenza C). · pazienti con insufficienza mitralica moderata o severa, o con trombi in atrio sinistro.
Bibliografia . 1. Rahimtoola SH, Valvular Heart disease. In: Stein J, ed. Internal Medicine; 4th ed. St. Louis: Mosby-Year Book;1994:202-234.
2. Kawanishi DT, Rashimtoola SH, Mitral Stenosis, In: Rashimtoola SH, ed. Valvular Heart Disease II. St. Louis : Mosby;1996:8.1-8.24.
3. V. Fuster, R.W. Alexander, R.A. O’ Rourke et al “Hurst’s The Heart” 11th ed. Mc Graw Hill, 2004
4. Bonow et al ACC/AHA practice guidelines JACC 2006 vol. 48 n 3 598-675.
5. Wen-Chih Wu et al “The use of stress echocardiography in the assessment of mitral valvular disease” ECHOCARDIOGRAPHY, Volume 21, July 2004: 453-454
6. Caso P. et al “Stenosi mitralica:valutazione ecocardiografica” Ital Heart J Suppl.vol 3 luglio 2002.
7. De Simone L., Caso P., D’angelo G. et al Stenosi mitralica. In: SIEC, ed.Linee guida SIEC.Milano: Sintagma,1999:163-7.
8. Turi ZG, Reyes VP, Rayu BS, et al. Percoutaneous balloon versus surgical closet commissurotomy for mitral stenosis: a prospective, randomized trial. Circulation 1991; 1318-22.
9. Bonow RO, Carabello B, De Leon AC Jr. et al. Guidelines for the management of patients with valvular heart disease: executive summery. A report of the American College of Cardiology/ American Heart Association Task Force on practice guidelines ( Commitee on Management of patientes with Valvular Heart Disease). Circulation 1998; 98;1949-84
10. Hameed A, Karaalp IS, Tummala PP, et al. The effect of valvular heart disease on maternal and fetal outcome of pregnancy. J Am Coll Cardiol 2001; 37: 893-9.
11. de Souza JA, Martinez EE Jr, Ambrose JA, et al. Percutaneous balloon mitral valvuloplasty in comparison with open mitral valve commissurotomy for mitral stenosis during pregnancy. J Am Coll Cardiol 2001; 37: 900-3.
12. Fawzy ME, Kinsara AJ, Stefadouros M, et al. Long-term outcome of mitral balloon Valvotomy in pregnant women. J Heart Valve Dis 2001; 10: 153-7.
13. Multicenter experience with balloon mitral commissurotomy. NHLBI Balloon Valvuloplasty Registry Report on immediate and 30–day follow-up results. The National Heart, Lung, and Blood Institute Balloon Valvuloplasty Registry Participants. Circulation 1992;85:448–61
14. Palacios IF, Sanchez PL, Harrell LC, Weyman AE, Block PC. Which patients benefit from percutaneous mitral balloon valvuloplasty? Prevalvuloplasty and postvalvuloplasty variables that predict long-term outcome. Circulation 2002;105:1465–71.
15. Reyes VP, Raju BS, Wynne J, et al. Percutaneous balloon valvuloplasty compared with open surgical commissurotomy for mitral stenosis. N Engl J Med 1994;331:961–7
16. Ben Farhat M, Ayari M, Maatouk F, et al. Percutaneous balloon versus surgical closed and open mitral commissurotomy: seven-year follow-up results of a randomized trial. Circulation 1998;97:245–50.
17. Cohen DJ, Kuntz RE, Gordon SP, et al. Predictors of long-term outcome after percutaneous balloon mitral valvuloplasty. N Engl J Med 1992;327:1329 –35.
18. Orrange SE, Kawanishi DT, Lopez BM, Curry SM, Rahimtoola SH. Actuarial outcome after catheter balloon commissurotomy in patients with mitral stenosis. Circulation 1997;95:382–9. JACC Vol. 48, No. 3, 2006 Bonow et al. 2006:598–675 ACC/AHA Practice Guidelines.
19. Dean LS, Mickel M, Bonan R, et al. Four-year follow-up of patients undergoing percutaneous balloon mitral commissurotomy. A report from the National Heart, Lung, and Blood Institute Balloon Valvuloplasty Registry. J Am Coll Cardiol 1996;28:1452–7.
20. Wilkins GT, Weyman AE, Abascal VM, Block PC, Palacios IF. Percutaneous balloon dilatation of the mitral valve: an analysis of echocardiographic variables related to outcome and the mechanism of dilatation. Br Heart J 1988;60:299 –308.
21. Cotrufo M Percutaneous mitral commissurotomy versus open mitral commissurotomy: a comparative study Eur J Cardiothorac Surg 1999;15:646-51
22. Sagie A, Freitas N, Padial LR, et al. Doppler echocardiographic assessment of long-term progression of mitral stenosis in 103 patients: valve area and right heart disease. J Am Coll Cardiol 1996; 28: 472-9.
23. Arora R, Kalra GS, Murty GS, et al. Percutaneous transatrial mitral commissurotomy: immediate and intermediate results. J Am Coll Cardiol 1994; 23: 1327-32.
24. Palacios IF, Block PC, Wilkins GT, Weyman AE. Follow-up of patients undergoing percutaneous mitral balloon valvotomy. Echocardiographic restenosis after successful balloon dilatation of the mitral valve with the Inoue balloon: experience of a United Kingdom centre. Br Heart J 1993; 69: 418- 23.
25. Thomas MR, Monaghan MJ, Michalis LK, Jewitt DE. Echocardiographic restenosis after successful balloon dilatation of the mitral valve with the Inoue balloon: experience of a United Kingdom centre. Br Heart J 1993; 69: 418-23.
26. Iung B, Garbarz E, Michaud P, et al. Immediate and midterm results of repeat percutaneous mitral commissurotomy for restenosis following earlier percutaneous mitral commissurotomy. Eur Heart J 2000; 21: 1683-9.
|