|
Terapia dell’Embolia Polmonare
Antonio Aloia, Valentino Ducceschi, Giovanni Gregorio ASL SA 3 Vallo della Lucania Dipartimento Cardiovascolare U.O. Utic Cardiologia Ospedale San Luca Vallo della Lucania
Gli obiettivi della terapia della tromboembolia polmonare sono: la riduzione della mortalità, la prevenzione delle recidive e delle complicanze tardive rappresentate innanzitutto dalla sindrome post-flebotrombotica e dall’ipertensione polmonare cronica. Il cardine di tale terapia è rappresentato dagli anticoagulanti ad azione rapida come l’eparina, seguita da anticoagulanti orali, da iniziare non appena si ha il sospetto clinico, in assenza ovviamente di controindicazioni. Il trattamento della fase acuta varia tuttavia a seconda del quadro clinico. Da un punto di vista clinico possiamo distinguere pazienti critici e non critici. I pazienti critici possono presentarsi con 1) instabilità emodinamica: arresto cardiocircolatorio, shock, ipotensione arteriosa assoluta e relativa; 2) quelli senza apprezzabiei instabilità emodinamica, ma con almeno una delle seguenti manifestazioni: dispnea intensa, persistente o recidivante, sincope recente. I pazienti non critici sono quelli apparentemente stabili emodinamicamente, con una o più delle seguenti manifestazioni: dispnea/tachipnea di modesto grado, tachicardia, dolore toracico tipo pleuritico.
Misure di supporto emodinamico e respiratorio Le misure di supporto emodinamico e respiratorio comprendono innanzitutto l’ossigenoterapia: l’ossigeno antagonizza la vasocostrizione causata dall’ipossiemia, e va iniziata subito con sonda nasale e con flusso di 6-8 litri/minuto. In caso di dolore è consigliabile somministrare un’adeguata terapia antalgica, di solito con farmaci antinfiammatori non steroidei, nei casi più gravi può essere utilizzata la morfina. I pazienti che mostrano uno stato ipossico non correggibile devono essere sottoposti a ventilazione meccanica. Quelli con grave ipotensione o scarsa perfusione d’organo devono essere sottoposti ad un trattamento con farmaci inotropi e/o vasopressori. Nei pazienti con grave stato ipotensivo (PA sistolica tra 80 e 100 mmHg) è indicata l’associazione di dopamina e dobutamina iniziando con dosi rispettivamente di 2-5 µg/kg/min e 5-10 µg/kg/min con aumenti progressivi secondo l’evoluzione clinica. Nei pazienti in shock può essere utilizzatala noradrenalina in infusione e.v. di 0.1 µg/kg/min con aumenti progressivi fino a 1 µg/kg/min ; tale farmaco fa, tra l’altro, aumentare la pressione di perfusione coronarica e migliorare l’ossigenazione del ventricolo destro. Nei pazienti con scompenso del ventricolo destro e shock cardiogeno si può utilizzare la dobutamina, che oltre l’azione inotropa positiva presenta un effetto vasodilatante sull’arterie polmonari. Inoltre la dobutamina e la dopamina possono essere utilizzate nei paziente con embolia polmonare, basso indice cardiaco e pressione arteriosa normale. L’utilità dell’espansione del volume circolante è controversa e non si dovrebbero superare i 500 ml.
Trombolitici La terapia trombolitica in corso di embolia polmonare acuta è ancora oggetto di controversie ed in particolare si è perplessi sul rapporto rischio/beneficio che vede da una parte i rischi di sanguinamento, mentre dall’altra ci sarebbero i vantaggi della rimozione dell’ostacolo meccanico, con riduzione rapida della pressione polmonare (PAP) e delle dimensioni delle sezioni destre (Dx). E’ però vero che entro una settimana anche in terapia eparinica si ottengono riduzione delle dimensioni e della pressione delle sezioni destre. I trombolitici sono tutti attivatori del plasminogeno, e trasformano il plasminogeno a catena singola in plasmina a doppia catena. La plasmina scinde enzimaticamente la fibrina all’interno del trombo, ne distrugge la capacità di tessere la rete che imprigiona gli elementi figurati del sangue responsabile del veloce incremento del volume del trombo, e questo porta allo scioglimento del coagulo. I fibrinolitici si differenziano tra loro per la loro struttura chimica, il metodo di sintesi, il meccanismo di azione, la specificità nei confronti della fibrina, l’emivita plasmatica, l’antigienicità e la dose. Oggi possiamo distinguere i trombolitici in: · Trombolitici di prima generazione: Streptochinasi, Anistreplase, Urochinasi · Trombolitici di seconda generazione: Attivatore tissutale del plasminogeno (rtPA), Attivatore del plasminogeno di tipo urinario a catena singola (pro-Urochinasi, scu-PA), Stafilochinasi (Star) · Trombolitici di terza generazione: Reteplase (rPA), Lanoteplase (nPA), Tenecteplase (TNK-tPA) Indicazioni Nell’Embolia Polmonare massiva che di solito si accompagna a shock e/o ipotensione (definita come una pressione arteriosa sistolica < 90 mmHg o un calo pressorio > 40 mmHg per più di 15 minuti non causato da un’aritmia di nuova insorgenza, ipovolemia o sepsi), i dati dei grandi trials clinici dimostrano in maniera inequivocabile, in particolare se consideriamo i dati di sopravvivenza, che la terapia trombolitica è indicata. Nell’Embolia Polmonare sub-massiva, cioè nei pazienti che presentano normali valori della pressione arteriosa, adeguata perfusione periferica, e segni clinici, emodinamici ed ecocardiografici di scompenso ventricolare destro, la trombolisi può essere praticata in assenza di controindicazioni. Nell’Embolia Polmonare né massiva né sub-massiva, la terapia trobolitica non è indicata a meno che i pazienti non presentino una compromissione emodinamica secondaria a malattie cardiache o polmonari preesistenti. Quando dovremmo iniziare il trattamento trombolitico?. Oggi non è più richiesta la conferma angiografica per iniziare il trattamento trombolitico, questo perché questa tecnica è poco diffusa negli ospedali in particolare quelli periferici, ma innanzitutto perché tale procedura non è priva di rischi per questo tipo di pazienti, e si associa ad un aumento delle complicanze emorragiche. Per questi motivi può essere sufficiente il riscontro di una TAC polmonare che documenti l’ostruzione prossimale di uno dei rami dell’arteria polmonare, o una scintigrafia polmonare positiva, o la presenza di segni di cuore polmonare acuto accompagnati da un elevato sospetto clinico in pazienti senza preesistenti malattie cardiache o respiratorie importanti. Il trombolitico di scelta nel trattamento dell’embolia polmonare oggi è rappresentato dall’attivatore tissutale del plasminogeno (rtPA) che va così utilizzato: bolo di 10 mg e.v., seguito da infusione per 120 minuti con posologia commissurata al peso corporeo (Tab I)
Tabella I Dosi di rt-PA da infondere in 120 minuti in rapporto al peso corporeo dopo il bolo di 10 mg
Tab. I In molti studi clinici, ove era necessario ottenere un effetto rapido, è stato somministrata una dose di 0.6 mg/kg di rt-PA in 15 minuti. In alternativa possono essere utilizzati altri trombolitici, approvati dalla FDA americana ma che possono essere attualmente considerati superati:
Vi sono una serie di controindicazione al trattamento trombolitico che possono essere assolute e relative: Controindicazioni assolute · Emorragia interna in atto · Emorragia intracranica spontanea recente Controindicazioni relative · Interventi chirurgici importanti, parto, biopsia d’organo o puntura di vasi non comprimibili nei 10 giorni precedenti. · Ictus cerebrale ischemico nei due mesi precedenti · Emorragia gastrointestinale nei 10 giorni precedenti · Trauma importante nei 15 giorni precedenti · Chirurgia dell’occhio o neurochirurgia nel mese precedente · Ipertensione grave non controllata (sistolica > 180 mmHg, diastolica > 110 mmHg) · Rianimazione cardiopolmonare recente · Conteggio piastrinico < 100000/mm3, tempo di protrombina < 50% · Gravidanza · Endocardite batterica · Retinopatia diabetica emorragica
Complicanze della terapia trombolitica La complicanza maggiore della terapia trombolitica è il sanguinamento: l’incidenza globale media di emorragia maggiore è del 12%. L’incidenza di emorragia cerebrale in circa 900 pazienti arruolati in studi randomizzati è risultata 1.2%. Il potenziale beneficio della trombolisi deve essere sempre confrontato con l’aumento del rischio di emorragie. Pertanto, i pazienti a basso rischio, con pressione arteriosa normale, senza disfunzione del ventricolo destro, non dovrebbero essere sottoposti a trombolisi poiché il rischio di sanguinamento supera i benefici attesi della riperfusione dell’arteria polmonare. Particolare attenzione dovrà essere posta nell’escludere dal trattamento trombolitico i pazienti in cui la tromboembolia polmonare ha prodotto un episodio sincopale con trauma cranico. Infine bisogna ricordare che non si dovrebbe somministrare l’eparina finché l’infusione del trombolitico non sia terminata. Se è stata iniziata l’infusione di eparina (secondo lo schema di Raschke) prima del rt-PA, va preferibilmente sospesa durante l’infusione di quest’ultima e poi ripresa al termine.
Eparina Il trattamento con eparina non frazionata (UFH) dell’Embolia Polmonare (EP) è ampiamente riconosciuto fin dal classico studio clinico eseguito da Barritt e Jordan nel 1961. Le eparine a basso peso molecolare (LMWH) possono essere utilizzate nei pazienti affetti da EP stabile ma non sono consigliate dalle Linee Guida Europee nei pazienti con EP massiva, dal momento che tali pazienti sono stati esclusi da tutti gli studi sul trattamento dell’EP con LMWH. L’eparina inibisce la trombosi cambiando la conformazione dell’antitrombina ed accelera così la formazione dei complessi trombina-antitrombina di almeno mille volte. Una volta che questa neutralizzazione virtuale istantanea della trombina avviene, l’eparina viene rilasciata dal complesso ternario ed è disponibile per interagire con un’altra molecola libera di antitrombina. Le caratteristiche anticoagulanti dell’eparina sono largamente spiegate dal fatto che catalizzano l’effetto dell’antitrombina sulle proteine del sistema della coagulazione, compresa la trombina e i Fattori IX, X, XI, XII e il complesso tissutale del Fattore VIIa. Le eparine che contengono meno di 18 unità di zucchero, le eparine a basso peso molecolare, sono incapaci di legare in maniera adeguata contemporaneamente la trombina e l’antitrombina, e per questo, come vedremo, non hanno effetto sulla trombina, ma possono inibire il fattore Xa. Poiché l’inizio della sua azione è praticamente immediato quando somministrata per via parenterale, l’eparina non frazionata è l’anticoagulante di scelta quando è necessario instaurare una rapida anticoagulazione. La V Consensus Conference nordamericana sulla trombosi e gli agenti antitrombotici svoltasi nell’aprile 1998 ha consigliato di trattare i pazienti affetti da EP o TVP con una dose di eparina sufficiente a raggiungere una rapida scoagulazione portando il tempo di tromboplastina parziale attivato (aPTT) a valori che corrispondono ad un livello plasmatico di eparina di 0,30-0,60 anti –Xa UI, determinato con il metodo amidolitico. Per raggiungere questo scopo si consiglia di iniziare la terapia somministrando: eparina non frazionata 80 UI/kg endovena in bolo (di solito tra le 5000 e le 10000 UI), seguita da infusione di 18 UI/kg/ora, con successivisi adeguamenti posologici secondo il valore dell’aPTT in secondi o ratio rapportata al peso del paziente (normogramma di Raschke – Tab. II), ma non dovrebbe essere mai < 1250 UI/ora. La velocità di infusione dovrebbe tener conto del grado di scoagulazione indicato dall’aPTT (aPTT ottimale: rapporto aPTT paziente/controllo tra 1.5 e 2.5). Il dosaggio dell’aPTT dovrebbe essere eseguito dopo 4-6 ore dopo l’inizio dell’infusione. In alcune particolari situazioni, come nel caso di un’aumentata affinità per alcune proteine plasmatiche, potremo riscontrare una resistenza della risposta ad una determinata dose di eparina in termini di rapporto aPTT, in questo caso può essere utile il dosaggio dell’anti-Xa. Alternativamente in questo caso specifico possono essere utilizzate le LMWH.
Tabella II Infusione dell’eparina e.v. in base al peso corporeo Normogramma di Raschke modificato
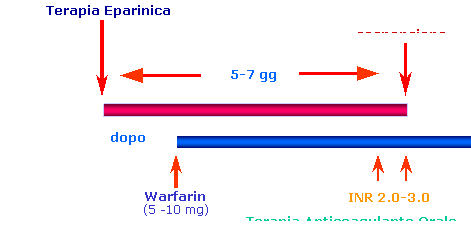
La terapia con eparina non frazionata va proseguita per 4-5 giorni e sospesa dopo aver verificato per 2 giorni consecutivi la presenza di livelli adeguati di anticoagulazione indotti dalla terapia con l’anticoagulante orale (INR 2.0-3.0). La terapia con gli anticoagulanti orali dicumarolici va iniziata, come vedremo dopo, entro 24-48 ore dall’inizio della terapia eparinica, embricata con questa per 4-5 giorni (Tab. V). La maggiore complicanza della terapia eparinica è il sanguinamento. I sanguinamenti maggiori smascherano di solito una patologia importante di solito silente, come una neoplasia del colon o della vescica. Nella maggioranza dei casi di sanguinamento di modesta entità basta sospendere la terapia, e l’aPTT ritorna dopo circa 6 ore alla norma, ricordando che l’emivita dell’eparina non frazionata è di 60-90 minuti. Possono predisporre al sanguinamento importante in corso di terapia eparinica la presenza di patologie concomitanti, un’età > 60 anni, un’eccessiva coagulazione, l’assunzione contemporanea di altri farmaci o la presenza di una disfunzione epatica o del sistema emocoagulativo. L’iniezione endovena intermittente di eparina è associata ad una maggiore incidenza di complicanze emorragiche rispetto all’infusione endovena continua. Quando si vuole neutralizzare l’effetto dell’eparina non frazionata, in caso di emorragie letali ed intracraniche, bisogna somministrare Solfato di protamina, proteina basica che blocca immediatamente l’effetto anticoagulante formando un complesso stabile con l’eparina acida. La dose che si consiglia somministrare è pari 10 mg di Solfato di protamina ogni 1000 UI di Eparina endovena lentamente (50 mg in 10-30 minuti). In corso di solfato di protamina si possono verificare reazioni allergiche, soprattutto in pazienti diabetici venuti già a contatto con la protamina per essere stati trattati con l’insulina neutra protamina Hagedorn. Il Solfato di protamina neutralizza l’attività anti-fattore IIa, ma determina solo una neutralizzazione parziale dell’effetto anti-Xa delle eparine a basso peso molecolare, probabilmente perché la protamina solfato non si lega ai componenti a peso molecolare molto basso. Nonostante l’incapacità della protamina solfato di neutralizzare tutta l’attività anti-fattore Xa delle eparine a basso peso molecolare, studi in modelli sperimentali animali indicano che l’aumentato sanguinamento microvascolare causato da concentrazioni molto alte di eparine a basso peso molecolare viene neutralizzato dalla protamina solfato. E’ incerto se la protamina solfato sia in grado di neutralizzare emorragie clinicamente importanti indotte da eparine a basso peso molecolare. Altre complicanze includono l’osteopenia, l’osteoporosi dose-dipendente, l’ematoma spinale ed epidurale, la necrosi cutanea, l’alopecia, reazioni di ipersensibilità, ipertransaminasemia da tossicità e l’ipoaldosteronismo che può determinare iperkaliemia in particolare nei pazienti affetti da diabete mellito o da insufficienza renale. La terapia eparinica può causare due distinti tipi di trombocitopenia. La forma più comune rappresenta un effetto collaterale benigno del farmaco ed è autolimitante. La forma più preoccupante è la forma autoimmune, HIT (heparin-indiced thrombocytopenia), che può determinare una grave riduzione della conta piastrinica e paradossalmente causare complicanze trombotiche potenzialmente letali, sia arteriose che venose. Quando si sospetta una HIT, qualsiasi sia la fonte o via di somministrazione, l’eparina deve essere immediatamente sospesa, questo determinerà in meno di 10 giorni un progressivo aumento delle piastrine. E’ cosa buona durante il trattamento controllare il numero delle piastrine a giorni alterni. La frequenza della HIT è maggiore con l’uso dell’UFH che con le LMWH. Comunque le LMWH non devono essere sostituite all’eparina non frazionata poiché hanno maggiore reattività crociata con sieri della HIT. Nella terapia profilattica dei pazienti sottoposti a sostituzione con protesi d’anca, la frequenza di HIT è risultata circa dell’1%. La diagnosi di HIT è difficile a causa della mancanza di esami di laboratorio e di criteri di riferimento. I test oggi disponibili sono: il test sul rilascio di serotonina, che è quello di riferimento, il test di Fratantoni, che è un test di aggregazione piastrinica, il test con Elisa, che rivela la presenza di anticorpi antieparina diretti contro il complesso eparina-fattore 4. Bisogna infine ricordare che l’eparina è l’anticoagulante di scelta in gravidanza, infatti a differenza del warfarin, essa non attraversa la placenta e non è teratogena. Le controindicazioni assolute alla terapia eparinica sono: emorragia interna in atto, recente emorragia endocranica spontanea, recente trauma cranico. Le controindicazioni relative alla terapia eparinica sono: interventi chirurgici importanti, biopsie d’organo o punture di vasi non comprimibili entro 10 giorni, ictus ischemico entro 2 mesi, emorragia gastrointestinale entro 10 giorni, traumi gravi negli ultimi 15 giorni, neurochirurgia o chirurgia oftalmica entro 1 mese, ipertensione arteriosa grave non controllata (pressione sistolica > 180 mmHg; pressione diastolica > 110 mmHg), conta piastrine < 100000 piastrine/mm3 oppure attività protrombinica < 50%, retinopatia diabetica emorragica. Le eparine a basso peso molecolare (LMWH) sono frazioni di eparine standard che si ricavano dalla depolarizzazione chimica o enzimatica delle catene polisaccaridiche. Le eparine a basso peso molecolare in definitiva presenterebbero rispetto all’eparina sodica i vantaggi di una maggiore biodisponibilità, minimo legame con le proteine, buona affinità per i fattori pro-coagulanti oggetto dell’azione delle molecole eparino-simili (antitrombina III, fattore IIa e fattore Xa). Per queste ragioni l’effetto anticoagulante è più prevedibile e non necessita di un monitoraggio stretto dell’aPTT. Queste eparine hanno avuto negli ultimi anni un ampio sviluppo in coincidenza con la dimostrazione di efficacia e sicurezza pari all’eparina non frazionata. Recentemente alcuni studi clinici, controllati e randomizzati hanno testato la sicurezza e l’efficacia delle LMWH nel trattamento dell’EP non massiva nei confronti dell’UFH. Tra questi merita di essere ricordato lo studio Columbus, studio multicentrico che ha arruolato 1021 pazienti, di cui 750 affetti da TVP (trombosi venosa profonda) e 271 affetti da EP (embolia polmonare) accertata; questi pazienti sono stati randomizzati a una dose fissa di LMWH (510 pazienti) o a una somministrazione continua di UFH (511 pazienti). Contemporaneamente è stato iniziato il trattamento anticoagulante orale, che è stato continuato per 12 settimane. Ventisette (5,3%) dei 510 pazienti trattati con LMWH hanno avuto TEV ricorrente versus venticinque pazienti (4,9%) dei 511 trattati con UFH, che soddisfaceva i criteri di equivalenza stabiliti a priori. Sedici pazienti (3,1%) trattati con LMWH e 12 pazienti (2,3%) trattati con UFH hanno sperimentato episodi emorragici maggiori. Nel complesso, la mortalità era del 7,4% in entrambi gruppi. Quindi come abbiamo visto, non sono state registrate differenze tra i due gruppi in termini di sicurezza e efficacia, con un trend a favore delle LMWH. In un altro studio recente, eseguito da Simonneau et al, 612 pazienti con EP sintomatica non massiva, sono stati randomizzati a una dose fissa di LMWH (304 pazienti) o a UFH in dosi aggiustate. Contemporaneamente è stato iniziato il trattamento anticoagulante orale, che è stato continuato per almeno 3 mesi. L’end-point primario era rappresentato da una combinazione di eventi, rappresentata da morte, TEV ricorrente ed emorragie maggiori nei primi 8 giorni dello studio. Tale end-point è stato valutato anche a 90 giorni. Nei primi 8 giorni di trattamento, 9 pazienti di ciascun gruppo di trattamento svilupparono almeno uno degli end-point (2,9% nel gruppo UFH, 3% nel gruppo LMWH). A 90 giorni 22 pazienti del gruppo UFH pari al 7.1% e 18 del gruppo LMWH pari al 5.9% avevano sviluppato almeno un evento. Il rischio di emorragie maggiori era simile per tutta la durata dello studio. Questi dati come quelli di altri studi suggeriscono un’equivalenza in termini di efficacia e sicurezza dei due regimi terapeutici in pazienti affetti da EP non massiva. Quindi, in mancanza di studi clinici adeguati, le eparine a basso peso molecolare non possono essere utilizzate nell’embolia polmonare massiva. Come abbiamo già visto le LMWH non necessitano di alcun monitoraggio di laboratorio ad eccezione della verifica di un conteggio piastrinico prima dell’inizio della terapia, in quinta giornata e, successivamente, ogni 2-3 giorni se il trattamento viene protratto. Nei pazienti anziani e nei casi di insufficienza renale cronica (clearance della creatinina < 30 ml/min) il dosaggio deve essere ridotto e bisogna monitorare attività anti-Xa che va preferibilmente controllata mediante prelievo di sangue 4 ore dopo l’iniezione sottocutanea (valori ottimali di anti-Xa: 0.6-1.0 UI/ml in caso di 2 somministrazioni pro-die; 1.0-2.0 UI/ml per somministrazione unica). Infine nelle persone con grave obesità (indice di massa corporea > 35 Kg/m2) la posologia non è stata ben precisata e l’attività anti-Xa va controllata inizialmente. Vi sono a disposizione molte eparine a basso peso molecolare (Tab. III):
Tabella III Dosaggi terapeutici delle eparine a basso peso molecolare
Tab. III Se l’Embolia Polmonare si presenta immediatamente dopo intervento chirurgico, la terapia eparinica non dovrebbe essere istituita se non dopo 12-24 ore in caso di intervento chirurgico maggiore. Tale trattamento dovrebbe essere ulteriormente procrastinato in caso di sanguinamento in sede di intervento. In questi casi non bisognerebbe somministrare il bolo di eparina ed iniziare l’infusione con un dosaggio inferiore. Il valore dell’aPTT dovrebbe essere controllato ogni 4 ore dall’inizio del trattamento.
Anticoagulanti L’efficacia degli anticoagulanti orali nella prevenzione del tromboembolismo è stata dimostrata da numerosi studi clinici controllati. Gli anticoagulanti più utilizzati in Europa sono il warfarin (il più utilizzato in clinica), l’acenocumarolo ed il fluindione. Questi sono farmaci che vengono assorbiti nell’intestino e sono trasportati nel plasma attraverso l’albumina a cui si lega nel 97-99% dei casi. Successivamente vengono metabolizzati dal fegato ed eliminati in forma idrossilata dall’emuntorio renale attraverso le urine. Importante in questo gruppo di farmaci è l’emivita, più questa è lunga minori saranno le fluttuazioni del livello di scoagulazione. L’emivita plasmatica del warfarin è di 42 ore, dell’acenocumarolo è di 9 ore, e del fluindione è di 31 ore. Gli anticoagulanti inibiscono nel fegato la sintesi, vitamina K-dipendente, dei seguenti fattori della coagulazione: fattore II, VII, IX, X; inoltre limitano il processo di carbossilazione delle proteine C e S che sono proteine anticoagulanti, con conseguente diminuizione della loro attività. La terapia con gli anticoagulanti orali dicumarolici va iniziata entro 24-48 ore dall’inizio della terapia eparinica, embricata con questa per 5-7 giorni, e sospesa dopo aver verificato per 2 giorni consecutivi la presenza di livelli adeguati di anticoagulazione indotti dalla terapia anticoagulante orale (INR 2.0-3.0), valori più elevati di INR non hanno diminuito l’incidenza di VTE mentre ha aumentato le complicanze emorragiche che si manifestano con una frequenza 4 volte maggiore (Tab. IV).
Tabella .IV
Bisogna iniziare con una dose uguale a quella che si prevede per il mantenimento e cioè 5 mg/die per il warfarin, 3 mg/die per l’acenocumarolo e 20 mg/die per il fluindione. L’uso di elevate dosi di carico (20-40 mg di warfarin) non presenta vantaggi rispetto alle dosi più ridotte, anzi rende più difficile la stabilizzazione del dosaggio ed è potenzialmente pericolosa. Infatti, la rapida diminuzione della proteina C (anticoagulante fisiologico, vitamina K-dipendente, a corta emivita) non compensata dalla concomitante riduzione dei fattori vitamina K-dipendenti ad emivita più lunga (fattori II, IX e X) può indurre la comparsa di necrosi cutanea, particolarmente nei pazienti con deficit congenito di proteina C ed S, oltre che indurre uno stato di ipercoagulabilità. Successivamente saranno effettuati gli aggiustamenti posologici in base al valore dell’international normalized ratio (INR). Il monitoraggio dell’INR sarà eseguito quotidianamente fino al raggiungimento dei valori target (INR 2.0-3.0), quindi 2-3 volte alla settimana per le prime due settimane e poi meno frequentemente a seconda della stabilità del valore dell’INR. L’assunzione della TAO va effettuata in unica somministrazione, sempre alla stessa ora del giorno e comunque dopo il risultato del controllo. La terapia con anticoagulanti orali fino a quando va proseguita ? La terapia anticoagulante orale, dopo la fase iniziale, va proseguita per un tempo variabile che dipende dal tipo di tromboembolia e dalla presenza di fattori di rischio permanenti. In generale potremo dire che la terapia anticoagulante va proseguita: 1) per almeno 3 mesi, se la malattia tromboembolica è associata a fattori di rischio temporanei (interventi chirurgici, immobilizzazione, traumi o fratture); 2) per almeno 6 mesi, in caso di EP idiopatica o assenza di TVP documentabile; 3) almeno 12 mesi o a tempo indefinito in caso a) di primo episodio embolico associato a neoplasia attiva, anticorpi antifosfolipidi o deficit di antitrombina III, b) di recidiva tromboembolica idiomatica o associata a stato trombofilico (esempio presenza di fattore V Leiden allo stato omozigote, iperomocisteina, deficit di proteina C o s, alterazioni trombofiliche multiple). La più comune complicanza della terapia anticoagulante è l’emorragia, che è correlata al grado di scoagulazione. Vi sono numerosi studi che dimostrano che il sanguinamento è più frequente con valori di INR > 3.0, e analisi multivariate suggeriscono che il rischio viene influenzato da malattie di base e dall’età. Le complicanze emorragiche possono smascherare una patologia come un tumore renale, una neoplasia, un’ulcera gastrointestinale, oppure un aneurisma cerebrale. In caso di emorragia da anticoagulante orale si deve sospendere il farmaco e bisogna somministrare vitamina K (fl da 10 mg) per via orale o parenterale, che fa di solito regredire l’effetto del warfarin in 6-12 ore. Se il paziente presenta un’emorragia importante bisognerebbe somministrare vitamina K in infusione e.v. , plasma fresco o complesso protrombinico concentrato. I fattori di rischio per emorragia nei pazienti in trattamento con anticoagulanti orali sono: una patologia epatica o renale grave, l’alcolismo, le interazioni farmacologiche, i traumi, i tumori maligni e precedenti episodi emorragici del tratto gastroenterico. La Federazione dei Centri per la Sorveglianza dei pazienti Anticoagulati (FCSA) ha recentemente condotto uno studio prospettico, multicentrico sulle complicanze emorragiche della TAO, che ha coinvolto 34 centri distribuiti in tutto il territorio nazionale. In tale studio 2700 pazienti, non selezionati, sono stati seguiti sin dall’inizio del loro trattamento anticoagulante per un follow-up totale di 2 anni/paziente. In questo studio l’incidenza di complicanze emorragiche è risultata pari a 7,5% anni/paziente. Di queste, 0,25% anni/paziente sono risultate fatali (emorragie cerebrali); 1,09% anni/paziente maggiori (6 digestive, 5 oculari, 4 cerebrali, 3 emartri, 2 emottisi, 1 retroperitoneale, 1 ematuria); e 6,2% anni/paziente minori (ematurie, proctorragie, meno-metrorragie, emorragie digestive, ematomi, ecchimosi, epistassi). L’incidenza di emorragie registrata in questo studio è risultata nettamente inferiore di circa 1/3 rispetto a quella osservata mediamente in altri analoghi studi osservazionali e analoga a quella registrata in studi clinici anche recenti ai quali erano ammessi solo pazienti altamente selezionati e quindi a basso rischio emorragico. Nel corso dello studio ISCOAT è stato registrato che le seguenti condizioni costituivano un fattore di rischio per la comparsa di complicanze emorragiche:
Non vi era correlazione significativa con il sesso, il range terapeutico desiderato, il tipo di farmaco anticoagulante usato (acecumarolo o warfarin). Sebbene il numero di complicanze emorragiche aumenti in misura esponenziale per valori di INR > 4,5, emorragie compaiono anche per valori molto bassi di INR. Nello studio ISCOAT si è verificata un’incidenza di emorragie del 7,6% anno/paziente a valori di INR < 2. Ciò conferma il fatto che la comparsa di manifestazioni emorragiche è talvolta da mettere in relazione alla presenza di lesioni organiche locali occulte. Oltre l’emorragia, il più grave effetto della terapia anticoagulante è la necrosi cutanea, che si manifesta nella prima settimana di trattamento. Questa complicanza, come abbiamo già visto, dovuto al deficit di proteina C, proteina S o di neoplasie. Poiché gli anticoagulanti possono attraversare la barriera placentare e determinare embriopatie ed aborto nel primo trimestre di gravidanze non devono essere somministrate, come pure nelle ultime 6 settimane perché potrebbero determinare sanguinamento. Per questi motivi in gravidanza andrebbero somministrate la UFH o le LMWH per via sottocutanea. Al momento di iniziare la TAO, è opportuno tenere presente il cosiddetto “triangolo della buona condotta terapeutica” costituito da: 1. laboratorio affidabile, 2. medico esperto, 3. paziente collaborante. Quando uno dei tre lati del triangolo non è corretto, aumentano i rischi della TAO. Controindicazioni assolute: · gravidanza (1° trimestre e ultime settimane di gravidanza); · emorragia maggiore (entro 1 mese dall’insorgenza dell’evento, specie se a rischio vitale). Condizioni a rischio di complicanze: · malattie psichiatriche (alcolismo, paziente non collaborante); · malattie cardiovascolari (ipertensione grave, endocardite batterica, pericardite, insufficienza cardiaca grave); · malattie renali (insufficienza renale grave, biopsia renale recente); · malattie neurologiche (recente accidente cerebrale di natura non embolica, recente chirurgia o trauma del SNC o dell’occhio (<3 mesi), aneurismi cerebrali); · malattie gastrointestinali (ulcera peptica attiva, varici esofagee, ernia iatale, diverticolosi del colon); · malattie epatiche (insufficienza epatica grave, malattie biliari, biopsia epatica recente); · malattie ematologiche (preesistenti difetti dell’emostasi, piastrinopenia, piastrinopatia); · miscellanee (puntura lombare, iniezioni arteriose [<3 mesi]). Anche le iniezioni intramuscolari vanno evitate. Per le vaccinazioni (p.e. antinfluenzale, antiepatite) si consiglia iniezione sottocutanea o nella massa muscolare comprimibile e controllabile a vista come il deltoide. L’età avanzata (>80 anni) è fattore di rischio emorragico, ma al tempo stesso coincide con l’epoca di insorgenza di un aumentato rischio tromboembolico legato a malattie cardiovascolari (ad es. fibrillazione atriale non reumatica). Laddove la TAO sia indicata si valuterà attentamente il rapporto rischio/beneficio. Va ricordato che esiste nell’anziano un maggior rischio di emorragie cerebrali per alterazione del metabolismo dei farmaci e probabilmente per alterazioni degenerative dei piccoli vasi. Questo rende necessaria un’attenta sorveglianza clinica, ma non costituisce di per sé una controindicazione. Prima di iniziare la TAO in un paziente, sia ricoverato in ospedale sia ambulatoriale, è opportuno che sia seguita una procedura standard al fine di: · escludere la presenza di controindicazioni maggiori e valutare le minori; · definire il motivo principale che porta al trattamento anticoagulante (ed eventuali altri motivi accessori); · definire il range terapeutico voluto; · stabilire la durata prevista del trattamento; · chiarire come e da chi sarà controllato ambulatorialmente il paziente. La procedura standard da seguire per rispondere ai punti suddetti deve prevedere una visita generale e l’esecuzione di alcuni esami di laboratorio. Occorre valutare il grado di cooperazione del paziente e la possibile presenza di condizioni che ne riducano o escludano l’affidabilità (deficit mentali, gravi psicosi, alcolismo, tossicodipendenza). Bisogna infatti considerare che per un adeguato trattamento occorre una completa e consapevole collaborazione da parte del paziente oppure la collaborazione da parte di familiari/conoscenti disponibili ad accudire il paziente stesso. La mancanza di entrambe queste condizioni è da considerare come una controindicazione assoluta al trattamento. La visita e la raccolta anamnestica escluderà la presenza di controindicazioni assolute e valuterà l’entità della controindicazioni relative. Esami di laboratorio preliminari: · test coagulativi di base (PT, aPTT, fibrinogeno, tempo di stillicidio); · esame emocromocitometrico completo con piastrine; · sideremia; · transaminasi, gamma-GT, colinesterasi, creatininemia, glicemia, uricemia, colesterolo, trigliceridi; · test di gravidanza in tutte le donne in età fertile. Recentemente uno studio di lungo periodo, lo Studio Prevent, che ha valutato l’effetto del Warfarin a basso dosaggio nella prevenzione delle recidive della trombosi venosa profonda e dell’embolia polmonare, ha dimostrato che l’anticoagulante utilizzato a bassi dosaggi offre un significativo beneficio nei pazienti con tromboembolismo venoso, senza significativi effetti indesiderati.
Terapie alternative In caso di controindicazioni assolute alla trombolisi o all’uso di anticoagulanti, possono essere utilizzate: • Embolectomia chirurgica: è un metodo efficace nei pazienti con Embolia Polmonare massiva in presenza di: 1) alto rischio di sanguinamento, 2) trombi nel cuore destro, 3) difetto del setto interatriale o forame ovale pervio con rischio di embolia sistemica. Tale procedura può essere eseguita previa documentazione del trombo con angiografia polmonare o TEE, è praticata raramente, e presenta un alto rischio di mortalità operatoria (20-50%). • Embolectomia meccanica con catetere in arteria polmonare:eseguibile per via percutanea con dispositivi che funzionano mediante aspirazione, frammentazione, reolisi con rimozione se non esistono controindicazione. Questa metodica può essere utilizzata in associazione alla trombolisi per aumentarne l’efficacia. Tuttavia, non si è ancora trovato un catetere ideale per l’embolia polmonare. • Interruzione della vena cava inferiore: con questo termine si intendono quelle procedure strumentali che consentono il posizionamento di filtri cavali per via percutanea di tipo permanente o temporaneo. Indicazioni:
Controindicazioni:
Attualmente sono disponibili numerosi nuovi modelli ( Bird’s Nest, Vena-Tech, Simon nitinol ) innovativi per la presenza di introduttori a guaina molto piccola con facilità di inserimento, accresciuta efficienza filtrante e possibilità di agevole rimozione.
CONCLUSIONI L’Embolia Polmonare è gravata da una alta mortalità. La gravità del quadro clinico è determinante nella scelta dell’approccio terapeutico:
A) Pazienti in condizioni non critiche · Eparina non frazionata: 80 UI/kg e.v. in bolo, seguiti da infusione di 18 UI/kg/h, con successivi adeguamenti posologici secondo il di aPTT in secondi o aPTT ratio (vedi Tab. I – Normogramma di Raschke). In alternativa possono essere impiegate: · Eparine a basso peso molecolare che non richiedono monitoraggio dei test di coagulazione. · Terapia anticoagulante orale con dicumarolici: preferibilmente con Warfarin 5 mg, va iniziata entro 24-48 ore dall’inizio della terapia eparinica, embricata con essa per 4-5 giorni. La terapia con eparina non frazionata va proseguita per 5-7 giorni e sospesa dopo aver verificato per 2 giorni consecutivi la presenza di livelli adeguati di anticoagulazione indotti dalla terapia anticoagulante orale (INR 2.0-3.0). La terapia anticoagulante va proseguita: 1) per almeno 3 mesi, se la malattia tromboembolica è associata a fattori di rischio temporanei (interventi chirurgici, immobilizzazione, traumi o fratture); 2) per almeno 6 mesi, in caso di EP idiopatica o assenza di TVP documentabile; 3) almeno 12 mesi o a tempo indefinito in caso a) di primo episodio embolico associato a neoplasia attiva, anticorpi antifosfolipidi o deficit di antitrombina III, b) di recidiva tromboembolica idiomatica o associata a stato trombofilico (esempio presenza di fattore V Leiden allo stato omozigote, iperomocisteina, deficit di proteina C o s, alterazioni trombofiliche multiple). · Terapia antibiotica: netimicina (Zetamicin fl 300 mg) 1 fl ev ogni 12 ore in associazione con cefotaxime (Zariviz fl 1 gr) 1 fl ev ogni 12 ore oppure imipenem cilastatina (Tienam fl 500 mg) 500 mg ev ogni 12 ore
B) Pazienti in condizioni critiche Embolia polmonare con instabilità emodinamica · Ossigenoterapia: l’ossigeno antagonizza la vasocostrizione causata dall’ipossiemia, va iniziata subito con sonda nasale e con flusso di 6-8 litri/minuto. I pazienti che mostrano uno stato ipossico non correggibile devono essere sottoposti a ventilazione meccanica; questa va effettuata con cautela a causa della riduzione del ritorno venoso causato dalla pressione positiva. · Terapia antalgica: farmaci antinfiammatori non steroidei, nei casi più gravi può essere utilizzata la morfina. · Arresto cardio-respiratorio: rianimazione cardio-respiratoria secondo le linee guida dell’AHA e le nuove ERC 2005. · Shock: noradrenalina in infusione ev di 0.1 µg/kg/min con aumenti progressivi fino a 1 µg/kg/min, che fa tra l’altro aumentare la perfusione coronarica e migliora l’ossigenazione del ventricolo destro. · Ipotensione (PA sistolica tra 80 e 100 mmHg): associazione di dopamina e dobutamina iniziando con dosi rispettivamente di 2-5 µg/kg/min e 5-10 µg/kg/min con aumenti progressivi secondo l’evoluzione clinica. · Trombolitici: il trombolitico di scelta nel trattamento dell’embolia polmonare oggi è rappresentato dall’attivatore tissutale del plasminogeno, rtPA, che va così utilizzato: bolo di 10 mg ev, seguito da infusione per 120 minuti con posologia commissurata al peso corporeo. · Eparina non frazionata: 80 UI/kg ev in bolo, seguiti da infusione di 18 UI/kg/h, con successivi adeguamenti posologici secondo il di aPTT in secondi o aPTT ratio (vedi Tab. I – Normogramma di Raschke). bisogna ricordare che non si dovrebbe somministrare l’eparina finché l’infusione del trombolitico non sia terminata. Se è stata iniziata l’infusione di eparina (secondo lo schema di Raschke) prima del rt-PA, va preferibilmente sospesa durante l’infusione di quest’ultima e poi ripresa al termine. · Terapia anticoagulante orale con dicumarolici: seguendo lo stesso schema di somministrazione per i pazienti non critici. · Terapia antibiotica: seguendo lo stesso schema di somministrazione per i pazienti non critici.
Embolia polmonare senza instabilità emodinamica · Eparina non frazionata (Tab. II) seguita da anticoagulanti orali: seguendo lo stesso schema di somministrazione per i pazienti non critici (vedi Tab. I – Normogramma di Raschke). · Trombolisi: da valutare caso per caso in base al rapporto rischio/beneficio. Anche se i trombolitici causano un più rapido miglioramento clinico-strumentale rispetto all’eparina, non vi sono studi randomizzati di proporzioni adeguate che abbiano dimostrato la superiorità in termini di mortalità nei pazienti con sovraccarico del cuore destro, ma senza ipotensione sistemica e/o shock. In questo tipo di pazienti l’impiego di eparine a basso peso molecolare al posto dell’eparina non frazionata ev non sembra sufficientemente convalidato dagli studi fin qui eseguiti.
BIBLIOGRAFIA
1. Adam Torbicki, Edwin J.R., et al. Linee guida per la diagnosi ed il trattamento dell’embolia polmonare acuta. Ital Heart J Suppl 2 (2): 161-199 2. Pietro Zonin, Giancarlo Agnelli, et al. Commento alle linee guida della Task Force sull’Embolia Polmonare della Società Europea di Cardiologia. Ital Heart J Suppl 2 (12): 1342-1356 3. Samuel Z Goldhaber, Luigi Visani, et al. Embolia polmonare acuta: esiti clinici dal registro Internazionale Cooperative Pulmonary Embolism Registry – Icoper. The Lancet vol.353 – n°9162: 1386-1389 4. Hull RD, Hirsh J, Jay R, et al. Different intensities of oral anticoagulant therapy in the treatment of proximal vein thrombosis. N Engl J Med 1982; 307: 1676-81 5. Holmgren K, Anderson G, Fgrell B, et al. One month versus six month therapy with oral anticoagulants after syntomatic deep vein thrombosis. Acta Med Scand 1985; 217:547-552 6. Braunwald Zipes Libby, et al. Malattie del Cuore 2003: 1972-1993 7. ANMCO: Trattato di Cardiologia : 2213-2253 8. Eric J. Topol: Cariologia interventistica – pp 78-104 9. Hurst, V.Fuster, et al. Il Cuore 2005: 1925- 1953 10. Ciro Indolfi, Carmen Spaccarotella. Diagnosi e Terapia in Unità Coronarica ed Emodinamica 2004: 177-180
|