DIAGNOSI DI SINDROME CORONARICA ACUTA : DUBBI E INCERTEZZE
C. Indolfi, C. Spaccarotella, A. Mongiardo
Cattedra di Cardiologia e Scuola di Specializzazione in Cardiologia, Università degli Studi Magna Graecia, Catanzaro
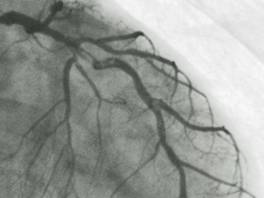
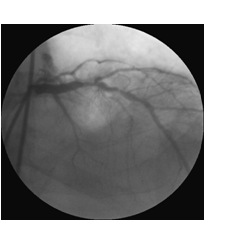
Le sindromi coronariche acute sono associate ad un aumentato rischio di morte cardiaca o anomalie della contrattilità del ventricolo sinistro ed è pertanto necessario effettuare una corretta diagnosi per un trattamento ottimale e per evitare evoluzioni più gravi. Il punto fondamentale è quello di ottenere informazioni rapidamente disponibili al momento della presentazione clinica iniziale. Purtroppo la presentazione clinica iniziale in alcuni casi, soprattutto nelle SCA NSTE, può essere ambigua, a volte simile a quella di soggetti nei quali successivamente non è stata trovata una malattia coronarica. Inoltre, alcune forme di infarto miocardico acuto non possono essere differenziate dall’angina instabile nel momento iniziale della presentazione clinica. La quasi totalità delle sindromi coronariche acute è causata da una trombosi acuta in una coronaria aterosclerotica (figura 1). In una piccola percentuale di casi le cause sono: lo spasmo coronarico, la ostruzione meccanica progressiva, l’infiammazione e/o l’infezione, l’angina instabile secondaria. Mentre la lenta progressione di stenosi coronariche critiche possono portare alla occlusione totale del vaso senza conseguenze cliniche (per la formazione di un circolo collaterale), l’occlusione improvvisa di stenosi non critiche (30-50%) è responsabile della maggior parte degli infarti miocardici1. La rottura della placca espone sostanze trombogeniche così da indurre una trombosi acuta costituita da fibrina, piastrine aggregate ed eritrociti. La rottura della placca è responsabile delle “sindromi coronariche acute” (angina instabile, infarto non “Q”, infarto “Q”)2.
Fig. 1 Stenosi coronariche responsabili di SCA.
L’aterosclerosi senza trombosi può essere considerata una malattia a prognosi meno infausta. Il meccanismo responsabile della conversione di una malattia coronarica stabile verso una sindrome instabile acuta è, di solito, una rottura della placca con una trombosi della lesione. La sfida della moderna Cardiologia sarà quella di diagnosticare (e quindi trattare) le placche non critiche, ma vulnerabili, responsabili delle sindromi coronariche acute per prevenire l’infarto o la morte improvvisa.
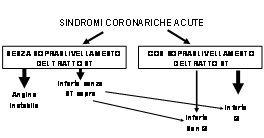
CLASSIFICAZIONE CLINICA
Inoltre tra le sindromi coronariche acute con sopraslivellamento del tratto ST non persistente deve essere inclusa la sindrome di Printzmetal che può presentarsi con i caratteri dell’angina instabile. Il processo dinamico della rottura della placca3 può evolvere verso un trombo completamente occlusivo o parzialmente occlusivo. Nel caso di un trombo completamente occlusivo si osserva tipicamente un sopraslivellamento del tratto ST all’elettrocardiogramma ed una necrosi transmurale della parete ventricolare compresa nella zona irrorata dalla coronaria colpita. I pazienti, successivamente, possono sviluppare o meno onde Q all’ECG (IMA “Q” o IMA non “Q”).
Trombi non occlusivi o costituiti da un tessuto fibrinico
meno robusto, possono provocare sintomi dell’angina instabile
alterazioni dell’elettrocardiogramma spesso consistenti in
sottoslivellamenti del tratto ST od inversione dell’onda T e,
qualora sia presente un aumento dei markers di necrosi
miocardica, evolvere verso un infarto miocardico senza
sopraslivellamento del tratto ST (NSTEMI) che più frequentemente
non lascia segni permanenti all’ECG (IMA non Q). I MARKERS BIOCHIMICI Il complesso troponinico è formato da tre subunità che regolano il processo contrattile della muscolatura striata mediata dal calcio. Le tre subunità sono la troponina C che lega il calcio, la troponina I (TnI) che si lega all’actina ed inibisce le interazioni astina miosina, la troponina T (TnT) che si lega alla tropomiosina, attaccando in tal modo il complesso troponinico al filamento sottile. Anche se le troponine I e T sono presenti sia nel muscolo cardiaco che in quello scheletrico, esse vengono codificate da geni diversi nel cuore per cui hanno anche una sequenza amminoacidica diversa. Ciò permette la produzione di anticorpi specifici per la forma cardiaca ed ha portato allo sviluppo di dosaggi quantitativi della troponina per uso clinico. Le troponine normalmente non sono presenti in circolo per cui il livello di cut-off può essere collocato solo poco sopra a quello del “noise”. Dopo l’insulto ischemico le troponine aumentano più di 20 volte in circolo permettendo di riconoscere minimo livelli di necrosi miocardica. Nei pazienti con IMA le troponine aumentano entro 3 ore e restano in circolo per 2-7 (troponina I) fino a 10-14 giorni (troponina T). La revisione pubblicata recentemente su Circulation delle linee guida ACC/AHA del 20024 sottolinea che i biomarkers cardiaci come la troponina (I e T) ed il CK-MB rappresentano il secondo metodo principale dopo l’elettrocardiogramma a 12 derivazioni per identificare i pazienti con SCA ad alto rischio di morte improvvisa od evoluzione verso infarto miocardio transmurale. Anche se il CK-MB è stato l'indicatore predominante nel passato di necrosi del miocardio, le troponine I e T hanno in molti centri sostituito questo indicatore tradizionale in conformità con i test di verifica recenti per la definizione nuova del MI acuto promulgata dalla società europea della cardiologia e dall’ACC. In molti laboratori è possibile ottenere i risultati dei dosaggi del markers cardiaci in 15-20 minuti dall’arrivo del paziente, anche se così precocemente alcuni pazienti con incrementi minimi di troponina non sono riconosciuti. Questo fattore deve essere considerato dal medico che valuta i risultati del laboratorio. L'aumento dei livelli di troponina è associato con il rischio aumentato di morte ed il rischio è proporzionale all’aumento del marker. Numerosi studi, infatti fanno della troponina un predittore indipendente del rischio del paziente con SCA. Gli studi inoltre hanno confermato che i pazienti con SCA e troponine elevate hanno maggiore beneficio se sono trattati con gli inibitori della glicoproteina (GP) IIb/IIIa, l'eparina a basso peso molecolare e l'intervento coronario percutaneo precoce (PCI). Bisogna ancora sottolineare che un livello normale di troponina (o di CK-MB) entro 6 ore dell'inizio dei sintomi, non escludono l’infarto. Devono essere effettuati pertanto controlli seriati a 3 e 6 ore e ad un intervallo di 6 - 10 ore, per escludere l’infarto. L'accuratezza predittiva per livelli di troponina elevati è ottenibile con l'uso del novantanovesimo percentile del valore normale per la troponina. È opportuno, per evitare falsi positivi, limitare la determinazione della troponina ai pazienti che hanno una probabilità medio-alta di ischemia miocardica acuta. La tabella I riporta i casi di aumento di troponina in assenza di cardiopatia ischemia. Recentemente, però, il semplice criterio di aumentato rischio legato all’aumento dei valori di troponina nei pazienti con UA/NSTEMI è stato però messo in discussione dallo studio ICTUS.
TABELLA I Aumento dei valori di Troponina in assenza cardiopatia ischemia. · Trauma toracico incluso contusioni, ablazioni e cardioversione. · Chirurgia cardiaca e non cardiaca. · Scompenso cardiaco (acuto e cronico). · Insufficienza renale. · Pazienti severamente malati (sepsi, insufficienza respiratoria, ustioni). · Tossicità da farmaci (citostatici). · Malattie infiammatorie (miocarditi). · Embolia polmonare e severa ipertensione polmonare. · Malattie infiltrativi (amiloidosi, sarcoidosi). · Malattie neurologiche acute (ictus, emorragia sub-aracnoidea).
Il Peptide Natriuretico Il peptide natriuretico di tipo B (BNP)5 è un ormone peptidico rilasciato dal ventricolo in risposta allo stretch miocardico o ad un incremento dello stress di parete. Il significato diagnostico e prognostico di elevati livelli di BNP in pazienti con scompenso cardiaco è stato a lungo studiato. In pazienti con infarto miocardico e ST sopraslivellato (STEMI), gli aumentati livelli di BNP sono associati con un infarto esteso, progressivo rimodellamento ventricolare sinistro ed un aumento della mortalità. Altri studi hanno dimostrato una stretta associazione tra elevati livelli di BNP ed un aumento dell’incidenza di eventi avversi in pazienti con UA/NSTEMI. L’associazione è ancora più forte se anche i livelli di troponina sono aumentati. Ancora non è, purtroppo, chiaramente definito il meccanismo fisiopatologico che lega i livelli di BNP all’aumentato rischio in pazienti con UA/NSTEMI. È stato ipotizzato che elevati livelli di BNP sono associati ad una più severa malattia coronarica e ad anomalie del flusso coronarico. Dei 2.220 pazienti dal trial TACTICS–TIMI-18, 1.114 sono stati randomizzati ad una precoce strategia invasiva. In 276 pazienti sono stati misurati i livelli di BNP. Di questi, 233 pazienti (84%) avevano livelli di BNP >80 pg/ml e 43 (16%) <80 pg/ml. I pazienti con BNP4 aumentato presentano una stenosi maggiore nel vaso colpevole (culprit vessel), un flusso peggiore ed erano associati ad una prevalenza di malattia del ramo discendente anteriore. Questi risultati suggeriscono che elevati livelli di BNP sono presenti soprattutto in caso di territorio infartuato esteso e potrebbero almeno in parte spiegare perché elevati livelli di BNP siano associati ad outcomes avversi. Nei pazienti a basso rischio con sindrome coronarica acuta UA/NSTEMI5 con un ECG a 12 derivazioni non significativo e negatività dei markers miocardio-specifici può essere eseguito un test da sforzo con o senza test di captazione del radionuclide. Se il test è negativo il paziente può essere dimesso e seguito in follow-up da un cardiologo. L’importanza della stratificazione del rischio deriva dal fatto che il beneficio dell’approccio invasivo, con rivascolarizzazione percutanea quando necessaria, è stato dimostrato solo in pazienti ad alto rischio. Secondo le linee guida europee (ESC-PCI 2005)6, i pazienti ad alto rischio per una rapida progressione verso l’infarto e la morte sono: · Pazienti con angina a riposo ricorrente. · Modifiche dinamiche del tratto ST: sottoslivellamento del tratto ST > 0.1 mV o transitorio (< 30 minuti) sopraslivellamento del tratto ST > 0.1 mV. · Aumento della Troponina I, Troponina T o del CKMB. · Instabilitità emodinamica durante il periodo di osservazione. · Angina instabile post-infartuale precoce. · Diabete mellito.
Inoltre nelle linee guida ESC PCI 20056 i seguenti markers di malattia potrebbero essere utili per la stratificazione del rischio in UA/NSTEMI:
Nelle SCA UA/NSTEMI possono essere adottate due strategie differenti: 1. Un’angiografia coronarica precoce a tutti (di solito entro le 48 ore) con successiva rivascolarizzazione, se indicata; 2. Un trattamento “conservativo” con terapia medica massimale incluso aspirina, clopidogrel eparina ed inibitori della GP IIB/IIIA ed angiografia con eventuale angioplastica nel caso di ischemia refrattaria alla terapia o ischemia inducibile (che di solito sono circa il 40% della popolazione con SCA UA/NSTEMI). Le linee guida AHA/ACC 20025 indicano le due diverse strategie di trattamento del paziente con UA/NSTEMI: una strategia precocemente invasiva ed una strategia precocemente conservativa. Nel primo caso l’angiografia coronarica è eseguita in pazienti senza controindicazioni cliniche alla rivascolarizzazione coronarica, nel secondo caso, l’angiografia è riservata ai pazienti con evidenza di ischemia ricorrente (angina a riposo o per minimo sforzo o modifiche del tratto ST) o stress test fortemente positivo nonostante una vigorosa terapia medica8. Vari trials hanno messo a confronto le due strategie, e, anche se i risultati non sono stati in tutti concordanti, il TACTICS-TIMI 18, FRISC II ed il RITA 3 Trial hanno evidenziato un beneficio nei pazienti trattati con strategia invasiva. La tendenza presentata anche dalle più recenti linee guida europee va verso una strategia invasiva precoce, in particolare nei pazienti ad alto rischio. Una recente metanalisi di Metha e collaboratori ha dimostrato il beneficio dell’approccio invasivo in termini di riduzione di infarto, angina severa e re-ospedalizzazione a lungo termine (17 mesi). La strategia interventistica di routine era associata, in questa metanalisi ad un aumento della mortalità intra-ospedaliera ed un trend verso la riduzione di mortalità a lungo termine. I recentissimi risultati dello studio clinico ICTUS in cui tutti i pazienti sono stati trattati con terapia medica massimale e successivamente sottoposti a trattamento invasivo precoce o a trattamento oinvasivo elettivo, indicano un’assenza din superiorità del trattamento invasivo precoce (entro 23 ore in media) rispetto al trattamento invasivo elettivo (entro 11.8 giorni in media).
In conclusione, i pazienti che presentano NSTE-ACS (angina instabile ed infarto senza sopraslivellamento del tratto ST) devono inizialmente essere stratificati per il rischio di complicanze trombotiche acute. Un chiaro beneficio per l’angiografia precoce (< 48 ore) e, se necessario, PCI o intervento chirurgico di rivascolarizzazione è stato dimostrato nei pazienti appartenenti al gruppo ad alto rischio. Differire l’intervento non migliora la prognosi. L’uso dello stenting è raccomandato sulla base della predittività del risultato e della sua immediata sicurezza9. In accordo con la WHO e la Società Europea di Cardiologia, la diagnosi di infarto miocardio acuto è basata sulla presenza di almeno due dei criteri seguenti: 1) dolore precordiale di tipo ischemico; 2) modificazioni dell’ECG in tracciati seriati; 3) incremento dei markers enzimatici di necrosi delle cellule miocardiche. Una classificazione dei pazienti con dolore toracico tipico o sospetto infarto miocardico si basa sulla presenza o assenza di sopraslivellamento del tratto ST. La maggioranza dei pazienti che presentano dolore precordiale e ST sopraslivellato andrà incontro ad elevazione degli enzimi indicativi di necrosi miocardica e svilupperà o meno onda “Q” all’ECG. Dei pazienti con dolore toracico tipico senza sopraslivellamento del tratto ST, alcuni presenteranno elevazione degli enzimi cardiaci con o senza sviluppo di onda “Q” all’ECG, altri, invece, non mostreranno incremento degli enzimi sierici e saranno classificati, successivamente, come angina instabile.
LA NUOVA DEFINIZIONE DELL’IMA La nuova definizione di IMA ha stabilito che i seguenti criteri soddisfano la diagnosi di infarto miocardico acuto, in evoluzione o recente:
Aumento dei markers biochimici di necrosi miocardica (preferibilmente troponina; se è utilizzata la troponina, le concentrazioni del marker dovrebbero essere maggiori del valore associato al 10% del coefficiente di variazione, se possibile in 2 determinazioni) con variazioni nei livelli sierici coerenti con il tempo accompagnati da: a) Sintomi ischemici; b) Sviluppo di onde “Q” patologiche; c) Modifiche dell’ECG indicative di ischemia (ST sopra o ST sotto);
L’aumento dei markers dovrebbe essere accompagnato da una evidenza strumentale oggettiva di ischemica miocardica quando: a) è disponibile un singolo prelievo; b) le modifiche dei valori dei markers nel tempo non coincidono con i sintomi. È opportuno, per evitare falsi positivi, limitare la determinazione della troponina ai pazienti che hanno una probabilità medio-alta di ischemia miocardica acuta. La troponina mostra una alta specificità e sensibilità potendo identificare anche aree molto piccole (1 gr) di necrosi miocardica9. Per valore elevato di troponina nel plasma, si intende un elevazione del marcatore al di sopra del limite di concentrazione pari al 99° percentile ottenuto nel gruppo di riferimento. Se il dosaggio delle troponine cardiache non è disponibile, la migliore alternativa è rappresentata dal CK-MB (preferibilmente misurata in concentrazione di massa, il valore deve essere >99° percentile dei valori del gruppo di riferimento in due successivi campioni o una concentrazione massima di CK-MB >2 volte il limite superiore di riferimento del laboratorio in esame, durante le prime ore dopo l’evento). I campioni di sangue su cui eseguire le determinazioni dovrebbero essere prelevati all’atto del ricovero, tra le 6 e le 9 ore dopo ed ancora tra le 12 e le 24 ore dopo, se le precedenti determinazioni sono risultate negative e le condizioni cliniche fortemente suggestive di IM in atto. Per ridurre al minimo i casi di falsi positivi si valutano insieme due marcatori: uno di rapido aumento nel sangue ed uno con cinetica di rilascio più lenta ma cardiospecifico, come la troponina. La mioglobina attualmente riveste il ruolo di marcatore precoce: è rilevabile nel sangue entro due-tre ore dall’inizio della sintomatologia. La strategia dei “due marcatori”9 è consigliata se il contesto in cui si agisce permette di modificare il percorso del paziente nel senso di una più precoce dimissione dal dipartimento di emergenza o di una più rapida strategia invasiva.
Il timing9 dei prelievi consigliato è a 4, 8 e 12 ore dopo l’ammissione, oltre al prelievo basale al momento del ricovero. La seconda strategia, che impiega solo la troponina, è applicabile in situazioni nelle quali l’urgenza di prendere decisioni cliniche è considerata meno critica od in condizioni in cui la prevalenza della malattia coronarica è significativamente più alta che nel dipartimento di emergenza (per esempio in UTIC). Il timing del prelievo per la troponina, in questi casi è: basale, a 6 e a 12 ore13.
Recentemente (Morrow e Braunwald, Circulation 2003) altri biomarker sono stati presi in considerazione. La proteina C reattiva (PCR) è imporante per individuare uno stato infiammatorio che può portare allo sviluppo di aterosclerosi ed è un predittore di prognosi peggiore a breve e lungo termine nei pazienti con cardiopatia ischemica. Altri biomarkers come il peptide natriuretico atriale e la clearance della creatinina potrebbero in futuro individuare una corretta stratificazione del rischio in pazienti con CAD.
L’ecocardiogramma è particolarmente utile nella diagnosi differenziale di un dolore toracico dubbio: dissezione aortica acuta, pericardite, versamento pericardico, embolia polmonare massiva. L’assenza di anormalità della cinetica segmentaria esclude nella maggior parte dei casi un infarto miocardico esteso.
In conclusioni, la diagnosi di infarto miocardico (con o senza sospraslivellamento del tratto ST) raramente presenta dubbi ed incertezze. Il problema diagnostico con molti dubbi ed incertezze è oggi quasi esclusivamente confinato alle sindromi coronariche acute con troponina negativa. Infatti la diagnosi di angina instabile è ancora oggi un problema clinico importante per la mancanza, spesso, di elementi oggettivi (tracciato negativo, dolore atipico). La sfida futura della Cardiologia sarà quella di identificare dei markers molecolari per la diagnosi rapida e sicura di angina instabile.
BIBLIOGRAFIA
|