|
La diagnostica strumentale nella Embolia Polmonare
G. D’Angelo, S. Saponara, M.L. Giovine, E.Vicinanza,.F.Mondillo* U.O. Cardiologia-UTIC ; Servizio Radiologia* - P.O. Eboli- ASL SA 2
Epidemiologia I dati sulla incidenza dell’Embolia Polmonare (EP) sono controversi, in quanto questa patologia rappresenta un’emergenza poco diagnosticata e a rischio di morte elevato. Studi autoptici indicano l’EP , come causa di morte, in una percentuale variabile tra il 2 e il 14%; in gruppi di pazienti anziani e a rischio (cardiopatici, BPCO, traumatizzati) si può giungere al 60%. Nello studio autoptico retrospettivo condotto nella Mayo Clinic (1) 2427 autopsie, 92 pz presentavano quadro autoptico diagnostico per EP massiva. In una revew di 8 lavori pubblicati tra il 1971 e il 1995 su 71667 autopsie, l’EP fu causa di morte in 4144 casi ( 5.7%) dei quali solamente 912 diagnosticati in vita. Attualmente in Italia l’EP viene considerata la terza causa di morte dopo malattie cardiovascolari e tumori. Studi clinici riportano una incidenza dell’EP stimabile in: - oltre 600.000 casi/anno ® USA - oltre 60.000 casi/anno ® Italia (100 nuovi casi/anno/100.000 ab) - oltre 1500 casi/anno ® Regione Veneto ( 25 nuovi casi/anno/100.000 ab); dati 1993 Il dato epidemiologico più recente è stato riportato nel lavoro di Cushman e coll. (2), che stima l’incidenza pari a 1.5 per 1000 persone/anno. Solamente un terzo dei casi di pz deceduti per EP vengono diagnosticati in vita e pertanto oltre il 70% di pz affetti da EP muoiono senza diagnosi. La prognosi dell’EP non trattata è frequentemente infausta: la mortalità è di circa 30%; il 16% nei primi 30 minuti, il 50% nelle prime 2 ore; la condizione emodinamica è la principale variabile collegata alla mortalità: 50-58% in pz. con instabilità emodinamica versus 8-15% nei pz. stabili ( 3) Inoltre 1/3 circa dei pz con EP sopravvissuti al primo episodio avrà una recidiva fatale. L’EP rappresenta la principale causa di morte nel 10% dei pz adulti ospedalizzati. L’incidenza di EP in ambiente ospedaliero oscilla tra 1% e 3.6% (4-5); pertanto è prevedibile avere su ogni 1000 ricoverati 20 casi di EP non mortale e 5 casi di EP mortale. Questa incidenza, come quella totale, tenderanno ad aumentare per una serie di ragioni, tra le quali vanno considerate: l’età media sempre più elevata della popolazione con un numero sempre maggiore di anziani sottoposti ad interventi chirurgici, l’aumento sempre più consistente della patologia neoplastica. E’ su questi pz che bisogna operare uno sforzo di “appropriatezza diagnostica e terapeutica “ ; la mortalità nei casi trattati è notevolmente più bassa, mediamente dell’8-10% Per completezza va ricordato che l’EP costituisce con la trombosi venosa profonda (TVP) una condizione anatomo-clinica strettamente correlata; di qui il termine unificante di “malattia tromboembolica venosa” che si riferisce al momento etiopatogenetico prevalente della malattia
Tabella I
Tabella 2
.
-Come riconoscere l’EP?
RICONOSCERE = RECOGNOSCERE ¯ “ ritornare indietro sulla conoscenza “
Il presupposto è dunque la “conoscenza“ della patologia, che presuppone la strutturazione di un modello di analisi del problema che venga attivato ogni qual volta il medico si trovi di fronte al pz con sospetto di EP. L’approccio diagnostico a questa malattia rappresenta un esempio di equilibrio tra “obiettivismo ed empirismo“, nel senso che il “riconoscimento“ della EP avviene attraverso “l’integrazione dell’esperienza clinica individuale con le evidenze cliniche migliori derivanti dalla ricerca sistematica“. Analogamente a quanto descritto da Galileo nel Saggiatore (1632) si osserva il “fenomeno“ (anamnesi ed esame obiettivo ), anche alla luce della propria esperienza, si formula “l’ipotesi di lavoro“ (ipotesi diagnostica), si verifica (indagini bioumorali e strumentali) e si traduce in “principio o legge “ ; a differenza però di quanto previsto nel “ metodo sperimentale “di Galileo, nei casi con forte sospetto clinico di EP, il decision making viene anticipato rispetto alla definizione diagnostica, considerato l’elevato rischio di mortalità presente in questa malattia in assenza di terapia. Pertanto l’attenta valutazione dei segni e sintomi (Tab 1) presenti nel pz al suo arrivo in P.S. , insieme, quando possibile, alla raccolta anamnestica, che miri essenzialmente alla individuazione di fattori di rischio e di condizioni favorenti la malattia tromboembolica venosa (Tab 2), rappresentano la premessa essenziale e determinante nell’iter diagnostico della EP. Se non c’è sospetto clinico, non ci può essere diagnosi. La triade classica, maggiormente patognomonica per la presenza di EP, è l’emottisi, la tosse ed il dolore toracico. I due trials internazionali, UK-SK (6)il Pioped (7) indicano, come prevalenti, nei pz affetti da EP i seguenti sintomi: tachipnea, dispnea e tachicardia, soprattutto quando improvvisi e in soggetti senza malattia cardiovascolare o polmonare preesistenti. Certamente le modalità di presentazione del pz con EP sono estremamente eterogenee: esordio drammatico in caso di EP massiva, nel quale prevalgono l’arresto cardiaco, lo shock, la sincope, la dispnea con dolore retrosternale oppressivo; esordio “ atipico “ nel quale prevalgono: sincope senza quadro associato di impegno ventricolare dx, febbre improvvisa, episodio di TPSV, improvvisa agitazione o dolore toracico puntorio, una riacutizzazione improvvisa di patologia respiratoria (ad es. tipo asmatiforme), dolore addominale “a cintura” o agli ipocondri, versamento pleurico ancor più se bilaterale, edema polmonare acuto asimmetrico, CID. Nel 10-30% di casi di EP, può determinarsi la comparsa di infarto polmonare; in tal caso il pz può presentarsi alla nostra osservazione lamentando l’insorgenza di dolore pleuritico con sfregamenti pleurici o versamento pleurico, tosse umida o secca, ittero o subittero, febbre. Accanto alla valutazione dei dati clinici e anamnestici, in ogni caso di EP vanno eseguiti, se le condizioni del pz consentono, una serie di indagini di primo livello: -Analisi bioumorali: transaminasi, LDH, bilirubinemia, emocromo, CPK, Dimero D -Emogasanalisi -ECG -RX Torace -Ecocardiogramma -Ecocolordoppler vasi venosi arti inferiori La sequenza di esecuzione sopra proposta è indicativa e dettata dalla comune esperienza di approccio al pz che giunge al PS e nel quale sia formulato il sospetto di questa malattia. Verosimilmente la sequenza nell’acquisizione dei risultati sarà diversa, se si tiene in debito conto il tempo necessario per i dati bioumorali e in particolare del Dimero D, quando eseguito con metodica ELISA. Negli ultimi anni sono stati sviluppati diversi modelli di valutazione della probabilità clinica di EP; tra questi riportiamo quello di Wells (8) , il quale ha costruito una scala di punteggio per definire il grado di probabilità: bassa probabilità < 2; media probabilità tra 2 e 6; alta probabilità > 6 ( Tab 2 )
Emogasanalisi Ipossiemia ( PaO2< 80mmHg ), Ipocapnia (PaCO2< 40mmHg ) ed alcalosi respiratoria costituiscono il risultato atteso di questo esame nel pz con EP. Va detto comunque che il riscontro di valori normali di PaO2 non esclude la diagnosi di EP ed allora si può ricorrere alla determinazione del gradiente alveolo-arterioso di O2 mediante la seguente formula:
Gradiente alveolo-arterioso= PAO2 alveolare – PAO2 arteriosa PAO2 alveolare= 150 – 1.2 (PCO2) ¯ Gradiente alveolo-arterioso= 150 – 1.2 (PCO2) – PAO2 arteriosa
Un valore di gradiente alveolo-arterioso < a 20mmHg è poco compatibile con la presenza di questa patologia, anche se non in maniera assoluta. Al pari la PCO2 può aumentare in tutti i casi in cui il pz non riesce ad aumentare l’attività ventilatoria come ad esempio avviene in pz sottoposti a ventilazione meccanica o nei pz con marcato dolore pleurico o in stato di shock magari a causa di EP massiva con grossa riduzione della per fusione ematica limitata ad un’area estremamente ridotta di polmone. I
Tabella 3
Tabella 4
l riscontro di ipossiemia è comunque abbastanza comune nei pz con questa malattia e se < 50 mmHg potrebbe indicare una occlusione importante del circolo polmonare > del 50%. Si ricordi di eseguire il prelievo arterioso con il pz che respira aria ambiente. Gli studi hanno dimostrato che esiste un valore diagnostico incrementale per l’emogasanalisi, tanto maggiore quanto più elevato è il sospetto clinico; certamente non può essere dimenticato la ridotta sensibilità e specificità del test, che può risultare alterato in numerose altre condizioni patologiche acute, in primis cardio-polmonari.
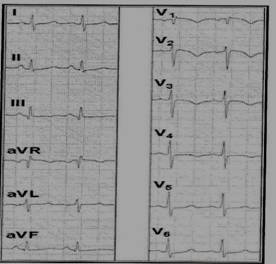
ECG “ tutto ei provò: la gloria maggior dopo il periglio, la fuga e la vittoria, la reggia e il triste esiglio; due volte nella polvere, due volte sull’altar ” Quest’esame ha l’enorme vantaggio di poter essere eseguito nella quasi totalità dei casi e nella quasi totalità delle condizioni e situazioni assistenziali. Come tutte le tecniche “antiche” e “diffuse” che conservano il ruolo a dispetto del nuovo, l’elettrocardiografia nell’approccio al pz con sospetta EP ha attraversato periodi di eclissi e momenti di rinnovato splendore. Certamente conserva un valore diagnostico differenziale non di poco conto, aiutando nella diagnosi differenziale con la sindrome coronarica acuta e con disturbi aritmici in grado di determinare sintomi da bassa gittata, dispnea, tachipnea e agitazione. Le alterazioni più frequenti rilevate nei pz con EP, la tachicardia e le alterazioni del tratto ST-T, mancano di specificità (9-10); di grande aiuto può essere la visione di tracciati precedenti l’evento per coglierne le differenze. E non può essere dimenticato la possibile preesistenza di alterazioni ecgrafiche in grado di mascherare i segni suggestivi di EP (tipo BBSn, ritmo da PM ecc.) o di altre che possono avvalorarne l’esistenza (tipo BBDx, alterazioni del tratto ST-T, variazioni fisiologiche dell’asse elettrico ecc.). D’altra parte l’ECG è anormale in oltre il 70% dei pz con EP (4-5) e l’inversione dell’onda T sulle derivazioni precordiali, se presente precocemente entro le prime 24 ore, identifica pz con EP massiva, con indice angiografico di Miller 50% e pressione media in arteria polmonare > 30mmHg (11). Nei casi più gravi di cuore polmonare acuto può rendersi evidente l’aspetto ecgrafico descritto da McGinn-White già nel lontano 1935 di S1Q3T3 o quello di S1S2S3. Altri segni ecgrafici correlabili alla EP sono stati descritti (Tab 3) con la piena consapevolezza della loro bassa specificità e della estrema variabilità nel tempo, correlabile alle variazioni funzionali del ventricolo dx e alle condizioni emodinamiche nel circolo polmonare. Recentemente l’ECG ha riconquistato un posto “sull’altare” del decision support system nel pz con EP: un valore di score > 10 risulta suggestivo di EP massiva con valore statistico di correlazione elevato (p< 0.001) rispetto alla severità dell’ipertensione polmonare (11). Kucher e coll. (12) hanno dimostrato in pz con EP la frequente presenza all’ECG di Qr in V1 insieme a sopraslivellamento del tratto ST ≥ 1mV; inoltre la negatività dell’onda T in V2 e il Qr in V1 rappresentano segnali elettrocardiografici di disfunzione ventricolare destra e quindi di decorso complicato della malattia (sensibilità 45 e 31%; specificità 94 e 97% rispettivamente).
Bisogna però anche ricordare che vi sono casi di EP non accompagnati ad alterazioni elettrocardiografiche: nello studio UPET il 14% di pz con EP presentava un ECG normale e di questi ben il 29% aveva una forma massiva o sub-massiva; nel PIOPED un ECG normale era documentabile nel 30% dei casi. Infine è giusto sottolineare che l’elettrocardiografia risulta una metodica utile anche nel monitoraggio dell’efficacia terapeutica e del decorso clinico: le onde T negative possono regredire, come anche le alterazioni del tratto ST e i disturbi di conduzione e del ritmo (10).
Rx Torace Risulta indagine ancora molto utile sia quando è alterata che quando è normale. Nel primo caso permette di escludere la presenza di EP allorquando dimostri la presenza di segni tipici di altra patologia pneumologica e/o cardiologica del tipo polmonite o pericardite; oppure permette di associare la presenza di alcuni aspetti radiologici ( Tab 4) frequentemente associati alla malattia tromboembolica venosa ancorché non specifici. Alcuni recenti trials internazionali (13) condotti in pz con EP riportano anomalie radiologiche toraciche presenti nel 70-80% dei casi; di queste le più frequenti risultano essere nel recente studio ICOPER (9) la cardiomegalia (27%) e la dilatazione dell’arteria polmonare (17%), che comunque poco correlano con la ipocinesia del ventricolo dx, importante predittore di mortalità. In conclusione possiamo dire che anche la radiografia toracica, se contiene elementi diagnostici di sostegno all’ipotesi iniziale di EP, rafforza la scelta di soluzioni terapeutiche immediate.
Tabella 5
D-Dimero I D-dimeri sono frammenti di fibrina originati dall’azione catalitica della plasmina; pertanto risultano elevati in pz che hanno prodotto notevoli quantità di fibrina con successiva fibrinolisi, come succede nei pz con EP, ma anche in altre condizioni fisiologiche (gravidanza, età avanzata, allettamento prolungato) e patologiche (epatopatie, neoplasie, polmoniti, scompenso cardiaco, intervento chirurgico). Alto valore predittivo negativo (91%), sensibilità elevata (96%), specificità bassa (47%); questi dati sono stati ottenuti in studi nei quali la titolazione del D-Dimero è stata realizzata mediante il test immunoenzimatico ELISA con un cut-off di 500nG/ml (14,15). Il D-Dimero negativo esclude con alta probabilità la presenza di Tabella 6
EP; se congiunto alla scintigrafia polmonare negativa, il valore predittivo negativo raggiunge il 100% (16). Sfortunatamente il tipo di test utilizzato con maggiore frequenza in emergenza per il dosaggio del D-Dimero in pz con il sospetto di questa patologia è quello al lattice che utilizza anticorpi monoclinali diretti verso questa sostanza; purtroppo la sensibilità scende all’83%. Nei pz con pregresso episodio di trombosi venosa profonda (TVP) o di EP seppure in trattamento con anticoagulanti orali il dosaggio del D-Dimero nei primi 6 mesi post-evento può risultare più alto, quale espressione di stato di ipercoagulabilità. In questa tipologia di pz nel caso di sospetta recidiva, la negatività del test al lattice per il D-Dimero esprime alta probabilità di assenza della recidiva di TVP o EP; la probabilità di test negativo è però due volte inferiore rispetto a quella rilevabile in pz con sospetto di malattia ma senza precedente storia clinica di TVP o EP (17)
Ecocardiogramma “ e l’avvio’, pei floridi sentier della speranza, ai campi eterni, al premio che i desideri avanza “. La prima documentazione ecocardiografica di EP acuta mediante esame ecocardiografico risale al 1977, allorquando fu documentato con tecnica M-mode un trombo intracardiaco dx “in transito” (18). I miglioramenti tecnologici, la diffusione, la facilità di esecuzione, la fattibilità, la ripetibilità, il basso costo, il rischio quasi inesistente in mani esperte della metodica per via transesofagea, ha comportato un prepotente impiego dell’ecocardiografia nel percorso diagnostico del pz con EP, che comunque risulta ancora ridotto negli studi generali sulla popolazione affetta da questa malattia( < al 50% ); ciò soprattutto se si considera la sua capacità di riconoscere condizioni patologiche in grado di simulare clinicamente l’EP, quali il tamponamento cardiaco, la dissecazione aortica, l’infarto miocardico acuto ecc. I limiti della metodica sono altrettanto importanti e sono: la relativa soggettività interpretativa, il problema “ finestra “, il possibile fattore confondente determinato dalla preesistenza di patologia cardiaca e/o respiratoria. L’ecocardiografia transtoracica (ETT) può fornire segni diretti e segni indiretti di EP( Tab 5). Il segno diretto più comune è rappresentato dalla trombosi in cavità destre o in polmonare; è un reperto occasionale, con prevalenza massima del 18%.In epoca di tecniche interventistiche non è eccezionale ritrovare, al di dentro delle sezioni cardiache destre o in polmonare, materiale migrante da protesi intracardiache o vascolari oppure, in caso di eventi traumatici, corpi estranei. Quando la documentazione è chiara e sicura, è inutile procedere ad altri esami diagnostici per la interpretazione del quadro clinico di EP (19,20). I segni indiretti di EP sono tutti da riportare alle variazioni del postcarico del ventricolo destro indotte dall’incremento del regime tensivo nel circolo polmonare. Nessuno è patognomonico di EP acuta; l’ipo-acinesia della parete libera del ventricolo dx con normo o ipercinesia dell’apice, segno di Mc Connel (21), sembra essere fortemente predittivo di EP acuta con specificità del 94% ed accuratezza diagnostica del 92%. Certamente, come anche da noi dimostrato, la ETT diventa ultimativa nell’iter diagnostico allorquando è possibile il confronto con esami ecocardiografici precedenti, eseguiti in assenza del quadro clinico e strumentale attuale, o se l’interpretazione dei dati ultrasonografici viene eseguita in combinazione con segni clinici, ecgrafici e radiologici (22,23); in tal caso si raggiunge una specificità del 93% ed una specificità dell’81%. Più delineato appare il ruolo della ETT nella stratificazione prognostica dei pz. con EP acuta. Nello studio osservazionale MAPPET la mortalità a 30 giorni è risultata del 105 nei pz con ventricolo dx ipocinetico, del 4% nei pz con normale funzione ventricolare. Ribeiro e coll. hanno studiato in pz con EP acuta la possibilità di prevedere, a breve termine, sia la mortalità( 24) sia lo sviluppo di ipertensione polmonare e di disfunzione ventricolare dx (25): i due studi hanno dimostrato che i fattori prognostici sono la gravità della disfunzione ventricolare dx per la mortalità, il valore di pressione sistolica in polmonare ( > 50mmHg) per lo sviluppo a 5 anni di ipertensione polmonare e di disfunzione ventricolare dx. Il valore prognostico della disfunzione ventricolare dx valutata con ETT nel predire l’outcome del pz con EP è stato confermato dal recente studio di Grifoni e coll. ( 26) che ha preso in considerazione quali marker di disfunzione del V Dx i seguenti parametri ecocardiografici: -DTD Vdx > 30mm o rapporto DTDVdx/DTDVsx > 1 in 4 camere -Movimento paradosso del SIV -Ipertensione Polmonare:tempo di accelerazione <90ms o gradiente Vdx/Adx>30mmHg Nel gruppo di pz normotesi, quelli senza disfunzione ventricolare dx ebbero una prognosi a breve termine buona; tra quelli con disfunzione ventricolare il 10% andò incontro a shock e il 5% morì. Qual’ è la migliore stategia terapeutica in questo sottogruppo di pz con disfunzione emodinamica latente? Può essere opportuno proporre, anche in assenza di quadro clinico di compromissione emodinamica, la trombolisi? La risposta a questa domanda non è al momento possibile dal momento che, come afferma giustamente Davidson nel suo editoriale pubblicato su Chest 2001, esistono in letteratura tesi contrapposte sulla efficacia della terapia trombolitica in questo set di pz; in aggiunta anche i criteri ecocardiografici per definire la disfunzione ventricolare dx nei lavori in questione sono differenti. La ripetibilità della ETT ha reso possibile lo studio della diversa efficacia dei farmaci utilizzati nel trattamento della EP; in particolare alcuni autori hanno dimostrato la positività e la rapidità di effetti dei fibrinolitici sulla funzione globale e regionale del ventricolo dx (27). La metodica ecocardiografica ha trovato nuovo slancio nello studio di questa malattia con l’applicazione della tecnica transesofagea (TEE). Noi riteniamo che la TEE sia da estendere come indicazione diagnostica nei casi di EP massiva; in oltre il 50% dei pz con quadro clinico e strumentale di impegno ventricolare dx è possibile documentare all’interno dell’arteria polmonare masse trombotiche(24 ). In particolare la maggiore frequenza è nel ramo destro, anche se le nuove sonde biplanari ed omniplanari consentono in mani esperte il rilievo di trombi anche nel ramo sinistro e nel primo tratto delle lobari. L’ecocontrastografia (28) applicata alla TEE può aiutare nella migliore definizione delle masse e nello studio dell’entità della compromissione emodinamica del pz ( studio della fossa ovale), riducendo la possibilità di falsi positivi. La TEE oggi si pone come tecnica diagnostica alternativa alla scintigrafia polmonare ed alla TAC spirale nella documentazione del trombo in questo set di pz, con maggiore fattibilità anche al letto del pz, anche se sottoposto a ventilazione meccanica e, in caso di positività, permette di arrestare l’iter diagnostico.
Scintigrafia polmonare Resta una metodica importante anche se di non facile esecuzione nei pz con quadro emodinamico instabile. Lo studio PIOPED condotto con la scintigrafia polmonare V/P ha sottolineato la capacità diagnostica nei pz con alta probabilità di EP dove raggiunge la specificità del 97%, aspetto presente però solamente nel 13% del totale dei pz studiati; in tutti gli altri, con probabilità intermedia fino a probabilità assente, la specificità varia dal 52% al 10%.In Italia lo studio PISA-PED condotto con l’utilizzo della scintigrafia perfusionale senza V/P ha dato risultati interessanti: la sensibilità è risultata del 92% e la specificità dell’88%.
TAC La diffusione dei sistemi con scansione rapida ( spirale) e con scansione ultrarapida a fascio di elettroni, pone questa tecnica di immagine come nuova possibile metodica di riferimento nell’iter diagnostico dell’EP, in grado di sostituire o almeno di affiancare l’angiografia polmonare nella capacità di documentare l’EP, con il vantaggio anche di poter documentare lesioni aggiuntive o condizioni patologiche alternative che escludono l’EP. In un recente lavoro di confronto tra TCA spirale ed Angiografia(29) condotto in pz con EP, la sensibilità e la specificità sono risultati rispettivamente del 90 e 94%, il valore predittivo positivo e negativo del 90 e 94%. Pertanto oggi l’angiografia polmonare andrebbe riservata ai pochissimi casi con alta probabilità clinica di EP, risposta scintigrafia dubbia e TAC spirale non diagnostica; sono i casi con piccoli emboli in arterie polmonari subsegmentari.
Angiografia polmonare Parlarne poco non significa discuterne il valore; ancora oggi viene considerato esame di riferimento nella diagnosi di EP. Se negli anni passati l’utilizzo era quasi indispensabile, oggi rappresenta l’eccezione. Costi elevati, invasività, non facile o non possibile esecuzione nel pz emodinamicamente instabile, rischi non trascurabili in presenza di ipertensione polmonare elevata, una morbilità variabile tra 1-4% ed una mortalità dello 0.2-0.4% (30 ), hanno ridotto l’applicazione dell’esame a casi selezionati di EP, nei quali magari si impone anche una diagnosi differenziale con altre patologie cardio-polmonari.
La descrizione analitica del contributo offerto dalle diverse metodiche cliniche e strumentali, alla definizione diagnostica della EP, è una ulteriore dimostrazione della difficoltà esistente nell’iter assistenziale ai pz con sospetta EP. Ciascuna metodica può fornire elementi utili per giungere al chiarimento di quadri clinici a volte complessi e lontani dalle comuni conoscenze in questa patologia subdola e ampiamente sottostimata. Bisogna però ribadire che nella definizione diagnostica della EP, più che in altre malattie, risulta determinante l’approccio clinico, volto a stabilire la probabilità di patologia, punto di partenza per la scelta delle ulteriori indagini strumentali da attuare. La TAC, con l’avvento delle apparecchiature 32-64 multislice, rappresenta oggi la metodica più diffusa, con elevata sensibilità e specificità, nonché con importante valore predittivo, con valori così elevati da indurre alcuni autori ad indicare questa tecnica quale metodica gold standard per la diagnosi di EP.
BIBLIOGRAFIA
1) Timothy I. Morgenthaler, M.D., and Jay H. Ryu, M.D. Clinical characteristics of fatal pulmonary Embolism. Mayo Clin Proc 1995; 70:417-424 2) Cushman M, Tsai AW, Wite RH et al: Deep vein thrombosis and pulmonary embolism in two cohorts: the longitudinal investigation of thromboembolism etiology. Am. J Med 2004; 117: 19-25 3) Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999; 353:1386-1389. 4) Stein PD, Henry J W. Prevalence of acute pulmonary embolism in a general hospital. CHEST 1995; 108: 978-981 5) Bell W, Simon T. Current status of pulmonary thromboembolism disease: pathophysiology, diagnosis, prevention and treatment. Am Heart J 1982; 103: 239-62 6) Urokinase- Streptokinase Pulmonary Embolism Trial: a national cooperative study. JAMA 229:1606, 1974 7) The PIOPED Investigators: value of the ventilation/perfusion scan in acute pulmonary embolism. JAMA 263: 2753, 1990 8) Wells PS, Anderson DR, Rodger M. Excluding pulmonary embolism at bedside without diagnostic imaging : management of patients with suspected pulmonary embolism presenting to the emergency department by using a simple clinical model and D-dimerr. Ann Intrn Med 2001 ; 135 : 98-107 9) E.Ferrari, A. Imbert, T. Chevalier, A. Mihoubi, P. Morand and M. Baudoy. The ECG in pulmonary embolism. Predictive value of negative T waves in precordial leads- 80 case report. CHEST 1997; Vol 11, 537-543 10) G. D’Angelo , C. Campaniello, M. Brigante, V. Iuliano, P. Bottiglieri, M. R. Di Muro. Alterazioni ecgrafiche in paziente con Embolia Polmonare – ANMCO 1998 11) Kurt R. Daniel, DO; D. Mark Courteny, MD and Jeffrey A. Kline, MD. Assessment of cardiac stress from massive pulmonary embolism with 12- lead ECG. Chest 2001; 120:474-481 12) Kucher N., Walpoth N, Wustmann K et al: Qr in V1- an ECG sign associated with right ventricular strain and adverse clinical outcome in pulmonary embolism. European Heart Journal Vol. 24, n° 12: 1113-1119 13) C.Gregory Elliot, MD, FCCP; Samuel Z. Goldhaber, MD, FCCP; Luigi Visani, MD and Marisa DE Rosa, Ph D. Chest radiographs in acute pulmonary embolism. Results from the international cooperative pulmonary embolism registry. CHEST, 118: 33-38, 2000 14) Bounameaux H, Perrier A. role of D-Dimers in the exclusion of pulmonary embolism. Semin in Resp and Crit Care Med 1996; 17:31-37 15) Goldhaber SZ, Simons GR, Elliot CG, et al. Quantitative D-Dimer levels among patients undergoing pulmonary angiography for suspected pulmonary embolism. JAMA 1993; 270:2819-2822 16) Bounameaux H, Slosman D, de Moerloose P, et al. Diagnostic value of plasma D-dimer in suspected pulmonary embolism. Lancet 1988; 2:628-629 17) Le Gal G, Righini M, Roy P.M. et al. Value of D-Dimer Testing fort he exclusion of pulmonary embolism in patients with previous venous thromboembolism. Archives of International Medicine : vol 166n° 2 176-180 18) Covarrubias FA Echocardiography and pulmonary embolism. Ann Int Med 1977; 87:72 19) Cheriex EC, Sreeram N, Eussen Y F, et al. Cross selectional Doppler echocardiography as the initial tecnique for the diagnosis of acute pulmonary embolism. Br Heart J 1994; 72:52-57 20) Chartier L, Bera J, Delomez M, et al. Free-floating thrombi in the right heart : diagnosis, management, and prognostic index in 38 consecutive patients. Circulation 1999;99:2799-2783 21) McConnell MV, Solomon S D, Rayan ME, et al regional right ventricular dysfunction detected by echocardiography in acute pulmonary embolism. Am J Cardiol. 1966; 78:469-473 22) Nazeyrollas p, Metz D, Jolly D, et al. Use of transthoracic Doppler echocardiography combined with clinical and electrocardiographic data to predict acute pulmonary embolism Eur Heart J 1966; 17:779-786 23) G. D’Angelo, P. Bottiglieri, C. Campaniello, M. Brigante, R. Battista, L. Martino, B. Rossi, R. Pisciotta. Valutazione poliparametrica nell’embolia polmonare. Abstract VII Congresso Regionale di Cardiologia ANMCO, 4-5 Dicembre 1998 24) Ribeiro A, Lindmarker P, Dannfelt AJ e coll. Echocardiography doppler in pulmonary embolism: Right ventricular dysfunction as a predictor of mortality rate. Am Heart J 1997; 77:346-9 25) Ribeiro A, Lindmarker P, Johnsson H e coll. Pulmonary embolism: one year follow up with echocardiography Doppler and five-year survival anlysis. Circulation 1999; 99:1325-1330 26) Griffoni S, Olivotto I, Cecchini P, Pieralli F, Camaiti A, Santoro G, Conti A, Agnelli G, BerniG. Short –Term clinical outcome of patients with acute pulmonary embolism, normal blood pressare, and echocardiographic right ventricular dysfunction. Circulation 2000;101:2817 27) Nass M, Mc Connell MV, Goldhaber S Z e coll. Recovery of regional right ventricular function after thrombolysis for pulmonary embolism. Am J Cardiol 1999; 83:804-6 28) Bottiglieri P, Campaniello C, Di Muro M.R., Carbone A, D’angelo G: Tomboembolia polmonare massiva: ruolo della metodica transesofagea, Ab. IX Congresso Nazionale SIEC, Milano 20-23 Aprile 1999. 29) Bottiglieri P, D’Angelo G, Di Muro M.R., Iuliano V, Carbone A, Brigante M: L’ecocontrastografia nell’embolia polmonare- Ab. VII Congresso Regionale ANMCO 4-5 Dicembre 1998. 30) Salah D Qanadli, Mostafa El Hajjam e coll.: Pulmonary Embolism Detection: Prospective Evaluation of Dual-selection helical CT versus Selective Pulmonary arteriography in 157 patients. Radiology. 2000; 217. 447-455. |