La terapia dell’ipecolesterolemia tra vecchi e nuovi farmaci Alberto Corsini, Dipartimento di Scienze Farmacologiche, Università degli Studi di Milano
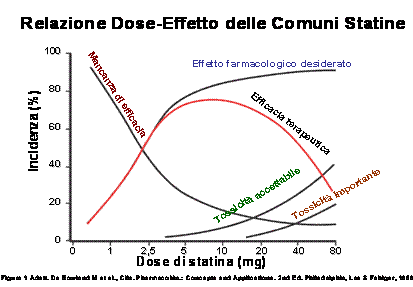
Introduzione Nel corso degli anni, vari studi epidemiologici hanno dimostrato come elevate concentrazioni plasmatiche del colesterolo-LDL (C-LDL) siano associate ad un aumentato rischio di patologie cardiovascolari. La terapia farmacologica delle ipercolesterolemie prevede soprattutto l’uso delle statine, farmaci in grado di inibire la sintesi epatica del colesterolo, di aumentare l’espressione dei recettori per le LDL e di ridurre le LDL plasmatiche. Studi clinici effettuati con statine hanno consentito riduzioni di C-LDL e benefici clinici mai raggiunti in precedenza, dimostrando come la relazione colesterolo-rischio cardiovascolare sia continua e graduale, ovvero senza un valore soglia al di sotto del quale tale rischio si annulli. Tali risultati sono stati recepiti da numerose Linee Guide nazionali ed internazionali (es.ATP III) che raccomandano riduzioni significative del C-LDL, specie in pazienti ad alto rischio cardiovascolare. Nonostante le terapie ipolipidemiche disponibili, non tutti i pazienti dislipidemici sono trattati adeguatamente. Lo studio Reality conferma come il raggiungimento delle concentrazioni ottimali del C-LDL raccomandati dalle Linee Guida si verifichi solamente nel 40% dei pazienti trattati (principalmente con statine) e come, nonostante il mancato raggiungimento degli obiettivi, solo nel 6-16% dei casi il medico decida di aumentare il dosaggio del farmaco, al fine di migliorare la terapia. Scarsa adesione al trattamento, regime dietetico scorretto dei pazienti, errata posologia, terapie concomitanti o fattori geneticamente determinati (mutazioni del recettore per le LDL, dell’apoproteina B100, della CETP ecc.) possono contribuire all’insuccesso del trattamento, suggerendo la necessità di interventi farmacologici diversi o combinati per un controllo più efficace della colesterolemia e per ridurre il rischio cardiovascolare del paziente. Gli studi PROVE-IT, A-to-Z, TNT, IDEAL, condotti con dosaggi elevati di statine in pazienti a rischio cardiovascolare, hanno dimostrato una riduzione più significativa degli eventi cardiovascolari rispetto a terapie con statine meno potenti od a dosaggi inferiori, confermando l’importanza di un approccio ipocolesterolemico aggressivo. Purtroppo, questi stessi dosaggi di statine si sono rivelati essere associati ad aumentato rischio di miopatie, epatopatie e mortalità non cardiovascolare. Dato che il raddoppio di una dose “convenzionale” di statina provoca, avvicinandosi allo “steady state”, solo un’ulteriore modesta riduzione del C-LDL (-6%) associata ad un incremento significativo della tossicità, ne consegue come una terapia combinata di una statina con un altro agente ipolipidemizzante possa essere più favorevole in termini di efficacia e di minori effetti collaterali (Figura 1).
Omeostasi del colesterolo Il contenuto medio di colesterolo in una persona adulta è 140 g, di cui solo 1,2 g soggetti a ricambio giornaliero. Come già ricordato, il colesterolo plasmatico, oltre che dalla biosintesi epatica deriva dall’assorbimento intestinale: ogni giorno assumiamo dalla dieta circa 300-700 mg di colesterolo che si assemblano con gli acidi biliari a circa 1000 mg di colesterolo biliare, formando micelle che ne permettono l’assorbimento intestinale. Circa il 50% del colesterolo nell’intestino tenue viene assorbito dalla mucosa, mentre il rimanente è escreto nelle feci. Una quota analoga di colesterolo viene sintetizzata dal fegato, evidenziando un contributo equipollente delle due vie di rifornimento quotidiano (Figura 2).
Controllo farmacologico dell’assorbimento intestinale del colesterolo Nuove importanti acquisizioni circa l’assorbimento intestinale del colesterolo, biliare e dietetico si sono ottenute con l’identificazione della proteina trasportatrice Niemann-Pick C1 Like 1 (NPC1L1), localizzata nell’orletto a spazzola delle cellule intestinali. Questa proteina, assieme ad altre, è coinvolta nella captazione e nel controllo dell’omeostasi del colesterolo nell’enterocita,. Pertanto, un ridotto assorbimento intestinale di colesterolo ne comporta una minore disponibilità epatica, un’aumentata captazione delle LDL ed una riduzione delle concentrazioni plasmatiche del C-LDL, ponendo le basi per un controllo farmacologico della proteina NPC1L1 (Figura 2).
L’ezetimibe, inibitore della proteina NPC1L1: meccanismo d’azione, farmacocinetica ed interazioni Il capostipite di questa nuova classe di farmaci, l’ezetimibe, inibisce selettivamente l’assorbimento intestinale del colesterolo dietetico e biliare nell’orletto a spazzola delle cellule intestinali, agendo sulla proteina NPC1L1. Il farmaco si lega agli enterociti con elevate affinità e specificità; infatti tale legame non si instaura in topi in cui l’espressione della proteina NPC1L1 è stata soppressa. Questa specificità d’azione è ribadita dal fatto che l’ezetimibe non inibisce l’attività di enzimi pancreatici, non sequestra acidi biliari e colesterolo, non influenza né l’attività di esterificazione né quella delle lipasi gastrointestinali e non interferisce con l’assorbimento di trigliceridi, estrogeni e progestinici, ma impedisce, in ultima analisi, il trasferimento del colesterolo dal lume intestinale all’enterocita, favorendone l’escrezione fecale (Figura 2). Nell’uomo l’ezetimibe inibisce l’assorbimento del colesterolo del 54%, riduce il C-LDL (-20%), quello totale (-15%), i trigliceridi (-7%) ed aumenta il C-HDL (2,7%). La minor diminuzione del C-LDL rispetto all’effetto indotto sull’assorbimento del colesterolo è dovuta ad un aumento omeostatico della sintesi endogena del colesterolo. L’ezetimibe, assunto per os, viene assorbito rapidamente, altrettanto rapidamente captato dalle cellule intestinali e glucuronidato dalle uridindifosfatoglucuronosiltrasferasi (UGT) 1A1 ed 1A3. Il glucuronide è farmacologicamente attivo e rappresenta il 90% della concentrazione plasmatica totale dell’ezetimibe, valutata 30 minuti dopo la somministrazione. La concentrazione del glucuronide è massima (45-70 ng/ml) 1-2 ore dopo l’assunzione del principio attivo, che invece raggiunge il picco (4-5 ng/ml) 4-12 ore dopo la somministrazione. Il glucuronide è rilasciato al fegato dal sistema portale e riescreto tramite la bile nel lume intestinale, ove si lega alla parete: nell’enterocita esso rappresenta più del 95% della dose somministrata. Sia l’ezetimibe sia il glucuronide si legano avidamente alle proteine plasmatiche (99,7% e 88-92% rispettivamente) e sono entrambi substrati della glicoproteina P (P-gp, ABCB1) e della Multidrug Resistance Associated Protein 2 (MRP2, ABCC2) che, assieme alla UGT1A1, ne determinano di conseguenza gli effetti farmacologici. Dall’andamento temporale delle concentrazioni plasmatiche si evince come l’ezetimibe subisca un effetto di ricircolo enteroepatico, importante nel prolungarne l’effetto farmacodinamico. L’ezetimibe viene eliminato immodificato per via fecale (80%), o renale (10%) se in forma di glucuronide. Situazioni fisiologiche e patologiche possono alterarne la farmacocinetica. Sebbene nell’anziano e nella donna le concentrazioni plasmatiche siano significativamente aumentate, l’effetto ipolipidemizzante è sovrapponibile a quello dell’adulto e non richiede aggiustamenti posologici. Questa attenzione è invece richiesta in casi di nefro- ed epatopatie, poichè le concentrazioni plasmatiche salgono fino a 6 volte oltre la norma. Studi di fase I hanno dimostrato come l’ezetimibe (10 mg) non interagisca con substrati specifici dei citocromi CYP1A2, CYP2C8, CYP2C9, CYP2D6, CYP3A4 e con la N-acetiltrasferasi. Inoltre, non sono riportate interazioni con warfarina, digossina, cimetidina, contraccettivi orali e soprattutto con statine, le cui concentrazioni plasmatiche sono immodificate nel caso di doppia terapia ezetimibe-statina. Sebbene due studi condotti con ezetimibe-gemfibrozil o fenofibrato abbiano mostrato un aumento del 50-80% delle concentrazioni plasmatiche dell’ezetimibe, d’altro canto la terapia ezetimibe/fenofibrato possiede un’efficacia complementare sul profilo lipidico in pazienti con dislipidemia mista; è infatti recente l’approvazione da parte della FDA della combinazione ezetimibe-fenofibrato nel trattamento di questa forma di dislipidemia. Interazioni di rilevanza clinica si verificano nelle combinazioni con ciclosporina o con colestiramina. Mentre nel primo caso si sconsiglia la cosomministrazione con l’immunosoppressore specie nei pazienti soggetti a trapianto renale (per aumenti da 3 a 10 volte nella concentrazione dell’ezetimibe), nel secondo caso il farmaco deve essere somministrato o 2 ore prima o 4 ore dopo la colestiramina, onde evitarne la riduzione nell’assorbimento da parte della resina. A causa della recente introduzione sul mercato e quindi della mancanza di letteratura, si sconsiglia precauzionalmente l’utilizzo dell’ezetimibe in gravidanza e nei bambini. I suoi effetti avversi più comuni, seppure moderati, sono diarrea e dolori addominali, anche se il rischio di litiogenesi non può ancora essere escluso.
L’associazione ezetimibe/statina: vantaggi ed aspetti clinici della duplice inibizione Dato che le concentrazioni plasmatiche del colesterolo sono determinate dalle componenti endogena ed esogena, l’approccio mirato al controllo di questi due contributi risulta non solo il più efficace, ma soprattutto il più razionale. Infatti il trattamento con statine determina un aumento dell’assorbimento del colesterolo, per una risposta omeostatica dell’organismo, mentre la monoterapia con ezetimibe, pur diminuendo l’assorbimento del colesterolo, ne aumenta la sintesi endogena. Per questi motivi, la duplice inibizione operata dall’ezetimibe nell’enterocita e dalla statina nell’epatocita esalta le proprietà farmacodinamiche e gli effetti ipolipidemizzanti dei due farmaci, mediante un meccanismo additivo e cooperativo rispetto alla monoterapia. La combinazione ezetimibe-statina, oltre a diminuire ulteriormente le concentrazioni del C-LDL, ottimizza l’effetto ipocolesterolemizzante e diminuisce i possibili effetti di tossicità. Per quanto riguarda sicurezza e tollerabilità, le percentuali di effetti collaterali dell’associazione ezetimibe/statine sono sostanzialmente sovrapponibili a quelle della monoterapia con statine dal momento che, come già indicato, l’ezetimibe non ne modifica la cinetica. Vari studi clinici hanno riportato gli importanti benefici della duplice inibizione non solo sulla colesterolemia, ma anche su altri importanti parametri, quali la funzionalità endoteliale e la proteina C reattiva, mentre altri sono in corso e saranno completati tra breve. Nello studio EASE è stata valutata l’efficacia di un trattamento di 6 settimane con ezetimibe 10 mg/die-statina in 3.030 pazienti a diverso rischio cardiovascolare, con elevato C-LDL, secondo le linee guida NCEP-ATP III. 1.010 pazienti sono stati trattati solo con statina, ottenendo una riduzione aggiuntiva (rispetto al precedente trattamento con statina) delle LDL del 2,7%. Nei 2020 pazienti trattati con statina/ezetimibe, la riduzione ulteriore (aggiunta di ezetimibe alla terapia statinica in atto) delle LDL è stata invece del 25,8%. Le concentrazioni di C-LDL raccomandate dalle linee guida NCEP-ATP III sono state raggiunte nel 71% dei pazienti trattati con statina/ezetimibe, mentre solo nel 21% del gruppo cui è stata somministrata esclusivamente la statina; Nel gruppo a più alto rischio cardiovascolare tali percentuali si sono attestate rispettivamente al 69 ed al 17%. Il confronto dell’efficacia dell’associazione ezetimibe (10 mg)/simvastatina (a diversi dosaggi) rispetto alla monoterapia con atorvastatina a dosaggi corrispondenti effettuato su 788 pazienti ha documentato a tutti i dosaggi coma la combinazione sia più efficace nel ridurre il C-LDL rispetto alla monoterapia con atorvastatina . Tra i numerosi studi in corso con end-point clinici, lo studio ENHANCE, ha lo scopo di valutare l’effetto dell’ezetimibe sulle lesioni vascolari, tramite valutazione della regressione dello spessore medio-intimale carotideo in 725 pazienti con ipercolesterolemia familiare eterozigote trattati con simvastatina 80 mg/ ezetimibe 10 mg o placebo. Lo studio SEAS prevede il coinvolgimento di 1400 pazienti ad elevato rischio coronarico (stenosi aortica asintomatica), trattati con simvastatina 40 mg/ezetimibe 10 mg o placebo, per esaminare la progressione della stenosi e soprattutto la prevenzione degli eventi cardiovascolari. Uno studio condotto in pazienti con insufficienza renale cronica (ad alto rischio di complicanze cardiovascolari) ha confermato il vantaggio di una terapia combinata simvastatina 20 mg/ezetimibe 10 mg nella riduzione delle LDL, ed è stato propedeutico per lo studio SHARP, in pazienti nefropatici cronici trattati con le stesse modalità, per valutare l'effetto della combinazione ezetimibe-simvastatina nei confronti di eventi cerebro- e cardiovascolari maggiori. Nello studio IMPROVE-IT si confronterà l’efficacia dell’associazione ezetimibe 10 mg/simvastatina 40 mg rispetto alla monoterapia con simvastatina 40 mg, in 10.000 pazienti con sindrome coronarica acuta, nel ridurre morte, infarto del miocardio e riospedalizzazione per sindrome coronarica acuta o rivascolarizzazione. Infine, l’associazione ezetimibe/simvastatina è stata contemplata anche in un braccio dello studio COURAGE, effettuato in pazienti con ischemia miocardica e patologia coronarica conclamata, per valutare il potenziale effetto benefico su morte ed infarto miocardico da parte di un intervento di stent coronarico in aggiunta a diversi trattamenti farmacologici. Riassumendo, alla luce di queste evidenze cliniche e sperimentali, ne consegue come la combinazione di farmaci con meccanismi complementari, ovvero la “doppia inibizione”, rappresenti l’approccio terapeutico innovativo ed ottimale per il controllo dell’ipercolesterolemia in pazienti ad alto rischio cardiovascolare.
|