Pio
Caso, Sergio Severino, Angela Fusco*, Salvatore Comunale, Lia Lo Piccolo*,
AR Martiniello, N Mininni, R Calabrò*
Diagnostica non Invasiva,Dipartimento di Cardiologia
*Cattedra di Cardiologia Seconda Università di Napoli, Azienda Ospedaliera
Monadi
La SM realizza un'ostruzione dell'afflusso ventricolare sinistro per la
presenza di anomalie strutturali a vari livelli dell'apparato valvolare
e tali da impedire il riempimento del ventricolo in diastole. La principale
causa è la cardite reumatica responsabile di tipiche deformazioni
morfopatologiche della valvola: ispessimento dei lembi, sia per fibrosi
che per depositi calcifici, fusione delle commissure e retrazione e/o fusione
delle corde tendinee. Rara è la SM congenita o da altre cause quali
severa degenerazione calcifica dell'anello, tumori dell'anello e dei lembi.
Essa colpisce in prevalenza donne (M: F = 1: 2) e, tra i vizi valvolari,
è la seconda per frequenza dopo la stenosi aortica. Si manifesta
in forma isolata nel 45% dei casi, mentre nel restante 55% è più
comune il riscontro di vizi associati (insufficienza mitralica, insufficienza
aortica ed insufficienza tricuspidale).
L'indagine ecocardiografica nelle sue varie modalità di esecuzione
è sempre raccomandata (classe I ACC/AHA ) nella diagnosi e valutazione
della severità della SM (gradiente medio, area valvolare e pressione
arteriosa polmonare) insieme alla valutazione delle dimensioni e della funzione
del ventricolo destro. Inoltre, l'ecocardiografia è indispensabile
per la definizione della morfologia valvolare (da cui dipende l'indicazione
alla valvuloplastica), per la diagnosi di severità e la valutazione
di vizi associati. L'approccio transesofageo è utile (classe IIa
ACC/AHA) per valutare la presenza o meno di trombi ed ecocontrasto spontaneo
in atrio sinistro, nel caso di pazienti candidati alla valvuloplastica o
alla cardioversione, per lo studio morfologico della valvola e per la valutazione
della severità dell'IM associata.
All'esame transtoracico le sezioni di riferimento sono rappresentate dalla
parasternale sinistra asse lungo ove si può studiare il doming del
lembo anteriore ,dalla short axis parasternale ove si studia l'area valvolare
e lo stato delle commissure,la tre camere per lo studio dell'apparato sottovalvolare
(Fig 1). Dai rilievi morfologici di mobilità, ispessimento, calcificazione
dei lembi e interessamento
Figura 1: Sezione parasternale asse lungo in diastole: si noti l'aspetto
a cupola con inginocchiamento del lembo anteriore (freccia). Ao= aorta,
AS= atrio sinistro, VD= ventricolo destro, VS= ventricolo sinistro
Figura 2: Sezione 4 camere apicale: profilo di flusso transmitralico al
Doppler continuo con linea di campionamento attraverso l'orifizio mitralico
allineata alla direzione del flusso.
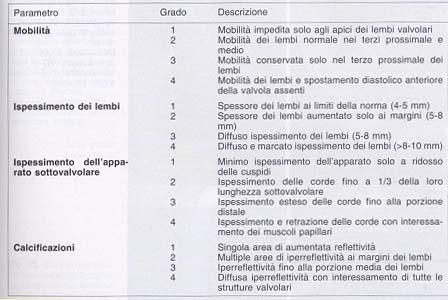
dell'apprato sottovalvolare è possibile costruire un punteggio (score) di gravità di interessamento dando a ciascuna di queste variabili un punteggio da 1 a 4 per cui una valvola ideale per valvuloplastica per cutanea dovrà avere un punteggio totale,considerando le quattro variabili, inferiore ad 8.( Tabella 1) Ai fini diagnostici il color Doppler transmitralico in 4 camere apicale è di maggiore utilità per l'identificazione della regione di convergenza in prossimità dell'orifizio stenotico e la direzione del jet nel ventricolo sinistro. La visualizzazione di quest'ultima è determinante per il corretto allineamento della linea di campionamento del Doppler continuo (DC) mediante il quale è possibile risalire al gradiente medio transtenotico secondo l'equazione di Bernouilli modificata (4 x V2) (figura 2). Tuttavia il gradiente è influenzato dalle caratteristiche del flusso transvalvolare per cui è indispensabile ricorrere al calcolo dell'area valvolare (AVM) con il metodo di cui si dispone. Un primo metodo è la misura dell'area planimetrica in asse corto parasternale marcando il margine interno dell'orifizio valvolare in telediastole; particolare attenzione va posta nel far si che il piano di sezione attraversi entrambi i lembi in modo coincidente al loro margine libero visualizzando la minima apertura dell'orifizio (figura 3).
Tabella
I
Valutazione ecocardiografica a punteggio della valvola mitralica secondo
Wilkins e Coll
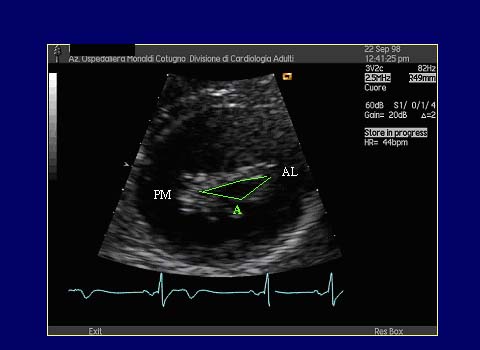
Figura 3: Sezione asse corto parasternale a livello dei lembi mitralici
in SM: planimetria dell'orifizio valvolare (A) che si presenta ridotto.
AL =commissura anterolaterale; PM: commissura posteromediale
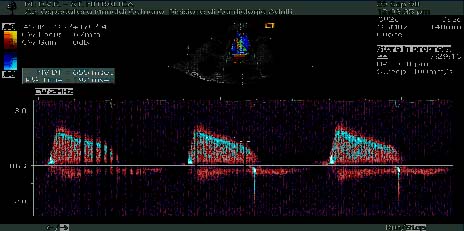
Figura 4 : Doppler continuo con calcolo automatico dell'emitempo di pressione
(PHT)
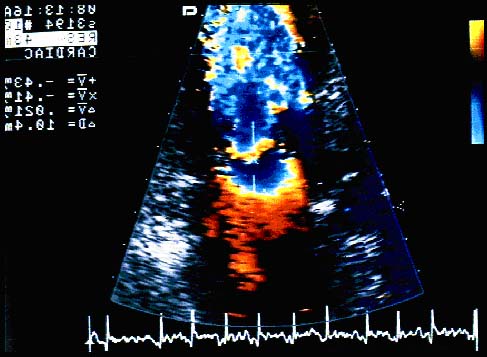
Figura 5: ColorDoppler dell'approccio transesofageo sezione 2 camere: si
evidenzia la regione di convergenza del flusso con passaggio di colore dal
giallo al blu che identifica l'emisfera corrispondente al primo aliasing.
Altro metodo è il calcolo del PHT (pressure half time) sul profilo
di flusso transmitralico e corrispondente al tempo intercorso tra il punto
in cui si inscrive la Vmax e quello intercetto. Gli attuali ecocardiografi
consentono di risalire a tale parametro mediante la pendenza del decadimento
della velocità di flusso transmitralico. Ottenuto il PHT viene diviso
per la costante empirica 220 risultando così l'area valvolare in
cmq (figura 4). L'area mitralica può essere calcolata anche applicando
l'equazione di continuità: poichè, in assenza di rigurgiti
o shunts, il volume di flusso transmitralico equivale alla gittata cardiaca,
l'AVM corrisponde a AVA x VA/VM (AVA, area valvolare aortica; VA, velocità
di picco aortica; VM velocità di picco mitralica). Tuttavia, tale
metodo è indaginoso e poco impiegato così come complesso è
il calcolo dell'AVM mediante metodo PISA (proximal isovelocity surface area)
con l'analisi color-Doppler della regione di convergenza. In presenza di
un orifizio circolare tale regione è costituita da superfici emisferiche
concentriche di isovelocità. In accordo con il principio di continuità
ogni superficie di isovelocità è costante ed è uguale
al flusso che attraversa l'orifizio L'AVM è calcolata secondo la
formula: AVM= volume flusso/ V (cm/sec) con V = velocità di picco
transmitralico. Il volume di flusso
(Q) è ottenuto moltiplicando l'area di una di queste superfici per
la velocità che la caratterizza, Q = 2p r2 x Vr ( r= raggio dell'emisfera
di
isovelocità al quadrato, Vr= velocità in cui compare l'aliasing).
Il limite del primo aliasing è facilmente identificato dal cambiamento
della codifca del colore con corrispondente velocità fornita dall'apparecchio.
La regione di accelerazione prestenotica del flusso è meglio visualizzata
dall'approccio transesofageo (figura 5.
La valutazione ecocardiografica della SM deve essere completata dalla misurazione
dell'atrio sinistro, dal calcolo della pressione polmonare e dallo studio
della funzione ventricolare sinistra e destra. La valutazione della funzione
ventricolare sinistra è necessaria poiché la portata cardiaca
condiziona i parametri di tipo funzionale quali i gradienti. La ridotta
funzione del ventricolo destro con insufficienza tricuspidale severa è
indice prognostico sfavorevole in vista di un recupero funzionale dopo chirurgia.
Completato lo studio ecocardiografico si definisce severa una SM con gradiente
medio = 12 mmHg, AVM = 1 cmq, PHT = 220 msec; pressione sistolica in arteria
polmonare = 50 mmHg.
L'integrazione dei dati ecocardiografici e clinici indirizzerà al
tipo di trattamento: terapia medica, valvuloplastica percutanea e chirurgia
conservativa o sostitutiva. L'indicazione alla valvuloplastica percutanea,
ormai affermata come valida alternatica alla chirurgia, è condizionata
dalla morfologia valvolare relativamente alle caratteristiche di ispessimento,
mobilità, calcificazioni dei lembi e coinvolgimento dell'apparato
sottovalvolare. Secondo lo score di Wilkins (tabella I).
Si pone indicazione alla valvuloplastica percutanea se vengono soddisfatti
i seguenti criteri: 1) score di Wilkins < 8; 2) SM severa e/o sintomatica
3) assenza di trombi in AS ed in auricola sinistra; 4) rigurgito mitralico
assente o di grado lieve. Si indirizza alla commissurotomia una SM con le
seguenti evidenze: 1) trombosi atriale sinistra; 2)calcificazioni asportabili;
3) fusione dell'apparato sottovalvolare passibile di trattamento conservativo.
La sostituzione valvolare è l'unica alternativa se: 1) score di Wilkins
elevato: estese calcificazioni a carico dell'apparato valvolare e sottovalvolare;
2) marcata retrazione cicatriziale dei lembi vallari; 3) fusione massiva
dell'apparato sottovalvolare.
Nel follow - up è opportuno seguire lo score di Wilkins, l'AVM, il
gradiente medio e la pressione polmonare. Dopo valvuloplastica oltre i suddetti
parametri vanno considerati anche l'IM residua ed il difetto interatriale.
BIBLIOGRAFIA
1)
Erlicher A, Panizza G. Le malattie della valvola mitralica, in G.L. Nicolosi:
Trattato di Ecocardiografia Clinica, by Piccin Nuova Librari, S.p.a.- Padova
, 1999; Vol II975-1080
2) Bonow RO, Carabello B, de Leon AC, Edmunds LH, Fedderly BJ et al. ACC/AHA
Guidelines for the Mnagement of Patients With Valvular Heart Disease. A
Report of the American College of Cardiology/ American Heart Asociation
Task Force on Practice Guidelines (Committee on Management of Patients with
Valvular heart disease). JACC 1998; 32: 1515 - 1525
3) De Simone L, Caso P, D'Angelo G, Iarussi D, Pagliuca MR et al. Stenosi
Mitralica. Società Italiana di Ecocardiografia Cardiovascolare, Linee
Guida. 1999, 163 - 67
4) Holen J, Simonsen S. Determination of pressure gradient in mitral stenosis
with Doppler echocradiography. Br Heart J, 1979; 41: 529-535
5) Deng YB, Matsumoto M, Wang XF, Liu L, Takizawa S. Estimation of mitral
valve area in patients with mitral stenosis by the flow convergence region
method: selection of aliasing velocity. J Am Coll Cardiol 1994; 24: 683-9
6) Wilkins GT, Weyman AE, Abascal VM, Block PC, Palacios IF. Percutaneous
mitral valvotomy: an analysis of echocardiographic variables related to
outcome and the mechanism of dilatation. Br Heart J 1988; 60:299-308
7) Nishimura RA, Holmes DR Jr, Reeder GS. Percuteneous balloon valvotomy.
Mayo Clinic Proc, 1990; 65: 198-220